Более сильный термический ожог вызовет кипящий сахарный сироп
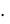
Модуль 1. Термодинамика. Кинетика. Катализ.
Занятие №4. Коллигативные свойства растворов. Сильные и слабые электролиты.
Цель: Вам необходимо овладеть учебной программой данного занятия и научиться применять данный материал в своей будущей профессии врача
Сделайте записи в рабочей тетради по плану:
• дата;
• номер занятия;
• тема занятия;
• цель занятия;
• основные вопросы темы;
Учебные вопросы занятия.
1. Коллигативные свойства растворов слабых электролитов:
1.1закон Рауля и его следствия;
1.2 диффузия, осмос, осмотическое давление, законы Фика и Вант — Гоффа.
2.Элементы теории растворов электролитов:
2.1 закон разведения Оствальда;
2.2 изотонический коэффициент. Теория Дебая-Хюккеля. Активность, коэффициент активности. Ионная сила.
3.Электролиты в организме. Осмотические свойства растворов электролитов.
3.1 Изоосмия, осмолярность, осмоляльность.
3.2 Роль осмоса в биологических системах. Плазмолиз и деплазмолиз
При отработке 1-го учебного вопроса
Обратите внимание на:
— понятия : раствор , растворитель, растворенное вещество, «коллигативные» свойства растворов;
-законы Рауля о давлении паров растворителя над раствором и изменении температур кипения и замерзания растворов неэлектролитов и электролитов;
-явления : диффузии, осмоса, осмотического давления и их роль в жизнедеятельности организмов;
— формулировку и математическое выражение закона Вант-Гоффа для неэлектролитов и электролитов.
Приведите примеры фармакотерапевтического воздействия на осмотическое давление.
При отработке 2-го учебного вопроса
Обратите внимание на:
— физический смысл изотонического коэффициента, его зависимость от различных факторов и значение для электролитов, не электролитов и веществ склонных к ассоциации.
— отличие сильных электролитов от слабых; степень диссоциации и константу диссоциации как количественные характеристики диссоциации слабых электролитов, их зависимость от различных факторов.
— взаимосвязь между константой диссоциации и степенью диссоциации, закон разведения Оствальда устанавливающий эту связь.
— теорию сильных электролитов – теорию Дебая-Хюккеля;
— понятия активность, коэффициент активности, ионная сила раствора; значение ионной силы плазмы крови и внутриклеточной жидкости как условие реализации биохимических и физиологических процессов.
При отработке 3-го учебного вопроса.
Обратите внимание на:
— понятия осмолярность, осмоляльностью и их отличие;
— необходимость учета осмолярности биологических жидкостей при введении лекарственных препаратов;
— явления изоосмии, эндоосмоса, экзоосмоса, цитолиза, гемолиза, плазмолиза;
— понятия: изо-, гипер-, гипотонический раствор и их применение в медицинской практике.
При проведении заключительной части учебного занятия
Выполните итоговое тестовое задание. Выслушайте преподавателя по оценке деятельности учебной группы и Вас лично. Обратите внимание на анализ преподавателем Вашей предстоящей работы на следующем занятии и нюансы при выполнении домашнего задания.
Рекомендуемая литература:
· Основная литература
1. Общая химия. Учебник для медицинских вузов. (, ), 976 с. –М, ГЭОТАР Медиа, 2009 г.
2. Практикум по общей и биоорганической химии. Учебное пособие для
студентов медицинских вузов ( Ред. ).- М., АКАДЕМИЯ., 3 изд., 235 с., 2008г.
· дополнительная литература:
1. Общая химия. Учебник для медицинских вузов. (, ), 976 с. — М, ГЭОТАР Медиа, 2007 г.
2. Биофизическая и бионеорганическая химия (, , ), М, МИА, 2008, — 416 с
3. «Химия: Основы химии Живого: Учебник для вузов. СПб: Химиздат, 20с.
4. Лабораторный практикум по общей химии: уч. пособие и др. – Ставрополь, 2003 г.
· программное обеспечение: общесистемное и прикладное программное обеспечение
· базы данных, информационно-справочные поисковые системы интернет ресурсы, отвечающие тематике дисциплины, в том числе: —Chemlib.ru, Chemist.ru, ACD Labs, MSU. ru., и др.
Образец билета контроль на «входе»
Билет№5
1. Более сильный термический ожог может быть вызван кипящим сахарным сиропом с массовой долей сахарозы, равный:
1) 2% 2) 5% 3) 8% 4) 10%
2. Осмотическое давление сантимолярного раствора AlCl3 по сравнению с сантимолярным раствором NaCl будет ___________.
3. В закрытом сосуде находятся 2 стакана: с чистой водой (1) и с водным раствором сахара (2). Через некоторое время:
1) уровень жидкости в стакане (1) понизится, в стакане (2) повысится
2) уровень жидкости в стакане (1) повысится, в стакане (2) понизится
3) уровень жидкости в обоих стаканах не изменится
4) уровень жидкости в обоих стаканах понизится
4. Меняется ли температура кипения раствора и чистого растворителя в процессе их кипения?
1) tкип растворителя не меняется, tкип раствора повышается
2) tкип растворителя и раствора повышаются
3) tкип растворителя повышается, tкип раствора не меняется
4) tкип растворителя не меняется, tкип раствора понижается
5. В месте воспаления осмотическое давление __________, поэтому нужно обрабатывать _________ раствором, чтобы вызвать _________ бактерий и микроорганизмов.
№1 Решение:
Согласно II закону Рауля повышение температуры кипения раствора по сравнению с растворителем рассчитывается по формуле:
∆Tкип = Ecm(X),
где cm(X) – моляльная концентрация растворенного вещества.
Между моляльной концентрацией и массовой долей существует математическая зависимость, из которой видно, что чем больше массовая доля растворенного вещества, тем больше и моляльная концентрация этого вещества в растворе
cm(X)=
Таким образом, самую высокую температуру кипения будет иметь раствор с массовой долей сахарозы, равной 10% следовательно, этим раствором можно получить более сильный термический ожог.
Ответ:4
№2. Решение:
NaCl и AlCl3 – электролиты, поэтому осмотическое давление растворов этих веществ рассчитывается по формуле:
Pосм = ic(X)RT.
Между изотоническим коэффициентом i и степенью диссоциации α существует математическая взаимосвязь: i =1 + α(n-1),
где n-число ионов, образующихся при диссоциации электролита.
Для AlCl3 n=4, для NaCl n=2, а т. к. эти вещества – сильные электролиты, то для них можно условно принять, что величина α равна 100%.
С учетом этого очевидно, что i(AlCl3) i(NaCl), следовательно,
Pосм (AlCl3) осм (NaCl).
Ответ: больше.
№3. Решение:
Так как давление насыщенного пара растворителя над водным раствором сахара согласно I закона Рауля ниже, чем над чистой водой, то в закрытом сосуде будет происходить диффузия молекул паров воды от стакана с чистой водой к стакану с водным раствором сахара. В результате этого:
а) давление пара растворителя над стаканом с чистой водой уменьшится, равновесие нарушится, поэтому в соответствии принципом Ле-Шателье скорость испарения станет больше скорости конденсации, что приведет к уменьшению уровня жидкости в стакане с чистой водой;
б) давление пара растворителя над стаканом с водным раствором сахара увеличится, равновесие нарушится, поэтому в соответствии с принципом Ле-Шателье скорость конденсации станет больше скорости испарения, что приведет к увеличению уровня жидкости в стакане с водным раствором сахара.
Ответ: 1
№4. Решение:
Температура кипения растворителя не меняется, так как подводимое к нему тепло тратится на эндотермический процесс испарения. Температура кипения раствора будет постепенно повышаться, так как в результате испарения растворителя моляльная концентрация растворенного вещества увеличится и в соответствии со II законом Рауля (∆Ткип =iEcm(X)) температура будет возрастать.
Ответ: 1
№5. Решение:
В месте воспаления в результате повышенного местного обмена веществ усиливается распад макромолекул на более мелкие фрагменты, в результате чего увеличивается количество частиц и, соответственно, осмотическое давление. По этой же причине рану нужно обрабатывать гипертоническим раствором, чтобы вызвать плазмолиз микроорганизмов и бактерий, а также отток (экзосмос) жидкости из раны в гипертонический раствор, что способствует ее очищению.
Ответ: … увеличивается … гипертоническим… плазмолиз.
Образец билета «тест-контроль на выходе»
Билет №5
1. Над раствором какого вещества давление пара растворителя больше, если температура и мольные доли растворенных веществ равны:
а) сахароза; б) CaCl2; в) Al2(SO4)3 ?
Ответ обоснуйте.
2. Ионная сила раствора определяется по формуле:
а) I = CRT; в) I = i – 1 / ν – 1;
б) I = f · C; г) I = ½ Σ Ci Zi2.
3. Как изменяется степень диссоциации слабого электролита при введении одноимённого иона
а) увеличивается; б) уменьшается; в) не изменяется?
Ответ обоснуйте.
Эталон ответа на вопросы билета
№1 Решение:
Согласно I закона Рауля ∆p = p0χB,
где ∆p – давления насыщенного пара растворителя над раствором;
p0 – давление насыщенного пара над чистым растворителем;
χB – молярная доля растворителя.
При образовании раствора концентрация растворителя уменьшается, его мольная доля становится меньше 1, и тем в большей степени, чем больше число кинетически активных частиц растворенного вещества:
а) C12H22O11, =1 (неэлектролит)
б) CaCl2 → Ca2++2Cl- , 3
в) Al2(SO4)3 → 2Al3++3SO42-, =5
Кроме того, растворение нелетучего вещества затрудняет испарение растворителя вследствие:
1) уменьшения подвижности молекул растворителя за счет взаимодействия растворитель – вещество;
2) уменьшения поверхности испарения, т. к. часть поверхности занята молекулами вещества.
Эти факторы приводят к смещению равновесия в сторону жидкости и уменьшению давления насыщенного пара растворителя над раствором.
Ответ: а)
№2 Решение:
В растворах электролитов существует взаимное влияние ионов: одноименные по заряду ионы отталкиваются, а разноименные – притягиваются. В результате электростатического притяжения часть ионов оказывается в связанном состоянии. Это приводит к изменению свойств раствора, эквивалентному уменьшению концентрации кинетически самостоятельных частиц, т. е. как бы снижению ионизации электролита, величина «степень ионизации» сильного электролита называется кажущейся. Взаимное влияние, мешающее ионам принимать участие в тех или иных процессах, усиливается по мере увеличения концентрации раствора.
Для количественного определения этого влияния используют величину ионной силы раствора I:
I=0,5 Ʃ Ci Zi, где
Ci- молярная концентрация иона в растворе, моль/л;
Z — заряд иона.
Ионная сила раствора – величина аддитивная, т. е. каждый электролит вносит свой вклад в величину I независимо от других.
Для каждого иона определенному значению ионной силы соответствует свой коэффициент активности, который показывает, какая часть ионов от общего числа находится в ионизированном состоянии.
Ответ: г)
№3 Решение:
Степень ионизации (диссоциации)- количественная характеристика ионизации слабого электролита
α=
Введение одноименного иона в раствор электролита, согласно принципу Ле-Шателье, способствует смещению равновесия процесса ионизации в сторону ассоциации (моляризации) ионов и увеличению общего числа недиссоциированных молекул. Степень диссоциации (ионизации) при этом уменьшается.
Ответ: б)
Источник
Макс Б. · 28 марта 2019
15,3 K
Прячусь за котиком от всех мировых проблем
Вообще стоило бы указать про какой именно ожог идет речь, из-за чего. Вот насчет ожогов кипятком или паром:
Что можно делать
- Необходимо сразу же устранить поражающий фактор (кипяток или пар);
- Охладить место поражения с помощью проточной воды;
- Закрыть влажной повязкой;
- Обеспечить покой.
Что нельзя делать
- Нельзя наносить мази, крема, масло, сметану и тд. Это может способствовать проникновению инфекции;
- Отрывать прилипшую одежду (при сильных ожогах);
- Прокалывать пузыри;
- Накладывать лед, снег.
Что рекомендуется делать сразу после получения ожога?
По образованию врач, по профессии — системный аналитик
Первое и самое главное — устранить причину ожога: покинуть горящее здание, потушить одежду и т.д.
Дальнейшие действия зависят от ситуации, характера ожога (термический или химический) и величины пораженного участка.
1) Если к телу прилипли куски ткани, не нужно пытаться отделить их самостоятельно, т.к. этим можно сильно усугубить ситуацию. В крайнем случае, стоит подержать пораженный участок под холодной водой. После этого лучше очень аккуратно удалить лишнюю воду (сухими стерильными салфетками или полотенцем), а затем наложить сухую стерильную повязку и обратиться к врачу.
2) Если ожог термический, при этом не очень большой и явно поверхностный, то пораженные участки лучше всего охлаждать проточной водой (не льдом!), причем подольше — минут 10-15. После этого их тоже нужно аккуратно подсушить и наложить свободную сухую стерильную повязку. Можно обработать пантенолом. Масла, кремы, мази использовать нельзя.
3) Если ожог обширный и/или глубокий, важно еще до приезда врача дать пострадавшему побольше жидкости (можно воду, но если есть раствор вроде регидрона, это будет лучше), место ожога закрыть стерильной свободной повязкой. Проточную воду при глубоких поражениях лучше не использовать, вместо этого можно аккуратно приложить к пораженному участку ткань, смоченную прохладной водой. Пантенол использовать не надо.
4) При ожоге негашеной известью нужно удалить кусочки извести, если они прилипли, а затем обработать место поражения маслом или другим жиром. Воду использовать нельзя.
5) При ожоге другими химикатами обычно допустимо длительное промывание в большом количестве проточной воды. Существуют более специфические рецепты для ожогов разными агентами, но если речь не идет об извести, вода подойдет.
Прочитать ещё 4 ответа
Чем помазать сгоревшую на солнце спину?
Врач-терапевт, опыт амбулаторного приёма пациентов 2,5 года. Закончила РНИМУ… · health.yandex.ru
Как правило, при солнечных ожогах на поврежденную кожу рекомендовано наносить препараты, стимулирующие восстановление тканей — Д-пантенол или его аналоги. Данные препараты лучше применть в форме спрея для равномерного нанесения. Если же форма препарата крем, то наносить необходимо тонким слоем на всю поврежденную поверхность.
В некоторых ситуациях, если ожоги довольно сильные и беспокоит повышение температуры тела или выраженная болезненность в местах ожогов могут быть рекомендованы противовоспалительные препараты — представители НПВС (Нимесулид, Ибупрофен или др).
Прочитать ещё 4 ответа
Как лечить мокнущие раны?
Врач-терапевт, опыт амбулаторного приёма пациентов 2,5 года. Закончила РНИМУ… · health.yandex.ru
При появлении мокнущих ран правильную схему лечения назначает врач-дерматолог. Как правило, в таких ситуациях рекомендуется:
- использование влажно-высыхающих повязок. Для этого необходимо сделать салфетку из 10-12 слоев марли или бинта, смочить ее в растворе антисептика (например, хлоргексидин) и «отжать», но таким образом, чтобы она не стала совсем сухой, но и при этом раствор не стекал с салфетки. Такую салфетку необходимо зафиксировать на поверхности раны с помощью бинта и «носить» в течение 30-40 минут
- использование ранозаживляющих средств, таких метилурациловая мазь (под повязку).
- для профилактики присоединения инфекции может быть использованы противомикробные средства (например, мазь Левомеколь)
- Стоит отметить, что мокнущую рану не рекомендовано «мочить» или промывать водой.До момента заживления лучше избегать приема ванны или длительного нахождения под душем.
- Необходимо следить за поверхностью раны, появление неприятного запаха, а так же бело-желтого налета может свидетельствовать о присоединении инфекции и требовать изменения схемы лечения.
Для правильно и эффективного лечения таких ран необходимо получить комплексное лечение по назначению врача исходя из данных осмотра, лучше избегать самолечения так как каждый препарат имеет свои противопоказания и нежелательные явления.
Источник

Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Скачиваний:
1704
Добавлен:
21.05.2015
Размер:
4.47 Mб
Скачать
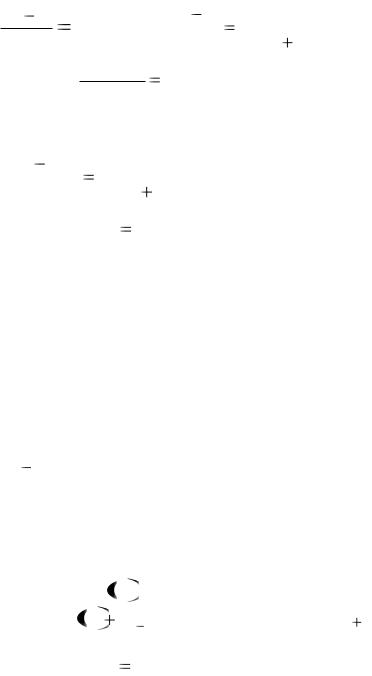
туры кипения помещѐнной в него воды, поэтому в этом случае вода закипит.
Задача № 4
Давление насыщенного пара над раствором, содержащим 5,2 г некоторого вещества в 117 г воды, равно при 70оС 307 кПа (р). Давление насыщенного пара над водой при той же температуре равно 312 кПа (ро). Определите молярную массу вещества.
Решение:
Согласно I закону Рауля
Ро Р | n(X) | ; | ||
P | n(X) n(Н | О) | ||
o | 2 | |||
117 г | = 6,5 моль. | |||
18 г/моль | ||||
Подставим данные в математическое выражение I закона Рауля и вычис-
лим n(X):
312 307 | n(X) | ||||||
; отсюда n(X) = 0,106 моль, соответственно, | |||||||
312 | n(X) 6,5 | ||||||
М(Х) = | m(Х) | 5,2 г | = 49 г/моль. | ||||
M (Х) | 0,106 моль | ||||||
Ответ: М(Х) = 49 г/моль.
Задача № 5
Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20оС. Давление насыщенного пара над бензолом при данной температуре 9953,82 Па.
Решение:
По I-му закону Рауля относительное понижение давления насыщенного пара над раствором равно молярной доле растворенного вещества:
Po
где Ро – давление насыщенного пара над растворителем; Р – давление насыщенного пара над раствором;
N(X) – молярная доля вещества (Х), которая определяется по формуле:
n X | n(С10 | Н8 ) | ||||||||
N(X) = n X | nр ля ; | N(С10Н8) = | ; | |||||||
n(С Н | ) | n(С Н ) | ||||||||
10 | 8 | 6 | 6 | |||||||
n(C10Н8) = | m | 6,4 г | = 0,05 | моль; | ||||||
M | 128 г/моль | |||||||||
n(C6Н6) = | 90 г | = 1,15 моль; | ||||||||
78 г/моль | ||||||||||
30

N(С10Н8) = | 0,05 | 0,042; | |||||
1,15 0,05 | |||||||
Po | P | = 0,042; | 9953,82 Р | = 0,042; Р = 9521 Па Ро. | |||
Po | 9953,82 | ||||||
Давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем.
Ответ: давление насыщенного пара над раствором равно 9521 Па.
Задача № 6
Вычислите температуру кипения и замерзания водного раствора фруктозы
( (С6Н12О6) = 5%).
Решение:
По II-му закону Рауля:
Ткип. = Е(Н2О) сm(X); Тзам. = K(Н2О) сm(X),
где Ткип – повышение температуры кипения раствора; Тзам – понижение температуры замерзания раствора;
Е(Н2О) – эбулиоскопическая константа для воды, справочная величина, равна 0,52 град кг/моль;
K(Н2О) – криоскопическая константа для воды, справочная величина, равна 1,86 град кг/моль;
сm(X) – моляльная концентрация вещества (Х).
сm(X) = | ω(X) 1000 | ; |
(100 ω(X)) M (X) |
5 1000
сm(С6Н12О6) = (100 5) 180 = 0,29 моль/кг;
Ткип = 0,52 град кг/моль 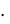 0,29 моль/кг = 0,15 град. tкип = 100оС + 0,15оС = 100,15оС.
0,29 моль/кг = 0,15 град. tкип = 100оС + 0,15оС = 100,15оС.
Тзам =1,86 град кг/моль 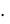 0,29 моль/кг = 0,54 град. tзам = 0оС 0,54оС = 0,54оС
0,29 моль/кг = 0,54 град. tзам = 0оС 0,54оС = 0,54оС
Ответ: 5%-ный раствор фруктозы закипит при 100,15оС, а замерзнет при
–0,54оС.
Задача № 7
Рассчитайте молярную массу неэлектролита, если его массовая доля в водном растворе 1,96%, а раствор замерзает при – 0,248оС.
Решение:
По II-му закону Рауля Тзам = K сm(Х),
где Kкр – криоскопическая константа воды, равная 1,86 град/(кг моль), сm(Х) – моляльная концентрация неэлектролита;
31

сm(Х) = | Tзам | 0,248 | 0,133 моль/кг . | |
Kкр | 1,86 | |||
По условию задачи в 100 г раствора содержится 1,96 г неэлектролита в
98,04 г воды:
сm(Х) = | m(X) | М(Х) = | m(X) | 1,96 | 150,4 г/моль . |
c | Х m | 0,133 0,098 | |||
M (X) mр | ля | m | р-ля | ||
Ответ: молярная масса неэлектролита равна 150,4 г/моль
Задача № 8
Определите, из скольких атомов состоит молекула серы, если температура кипения раствора 4,455 г серы в 50 г бензола на 0,905оС выше температуры кипения чистого бензола. (Е(С6Н6) = 2,60 град кг/моль)
Решение:
Согласно II закону Рауля:
Ткип. = Е(С6Н6) сm(SХ) или
Ткип. = Е(С6 | Н6 ) | m(SX ) 1000 | , отсюда | ||||||||||||
M (S | X | ) m(С | Н | ) | |||||||||||
6 | 6 | ||||||||||||||
М(SX). = | Е(С6Н6 ) m(SX ) 1000 | ; | |||||||||||||
Ткип. m(С6Н6 ) | |||||||||||||||
М(SX). = | 2,60 град кг/моль | 4,455 г 1000 | 256 г/моль ; | ||||||||||||
0,905 град 50 г | |||||||||||||||
х = | М (SX ) | 256 | 8 . | ||||||||||||
M (S) | 32 | ||||||||||||||
Ответ: Молекула серы состоит из 8 атомов.
Задача № 9
Температура замерзания 10%-ного водного раствора серной кислоты равна –5,5оС. Вычислите степень ионизации кислоты в этом растворе.
(K(Н2О) = 1,86 град кг/моль)
Решение:
Согласно II закону Рауля: Тзам. = i K сm(H2SO4). Рассчитаем сm(H2SO4) по формуле:
сm(H2SO4) = | ω(H2SO4) 1000 | ; | ||
(100 | ω(H2SO4)) M (H2SO4) | |||
сm(H2SO4) = | 10 1000 | = 1,134 моль/кг; | ||
(100 | 10) 98 | |||
tзам = tзам.(Н2О) – tзам.(р-ра) = 0 – (–5,5) = 5,5оС.
tзам = Тзам .
32

= 0,804 или 80,4%.
i = | Тзам. | 5,5 | 2,608 . | ||
K c | m | (H SO | ) | 1,86 1,134 | |
2 4 | |||||
i 1
= n 1 , где n – число ионов, образующихся при диссоциации H2SO4.
= 2,608 1 3 1
Ответ: = 80,4%.
Задача № 10
Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при – 0,23оС. Рассчитайте кажущуюся степень диссоциации хлорида цинка в данном растворе.
Решение:
Моляльная концентрация соли в растворе равна:
сm (ZnCl2) = 0,85 г/136 г/моль 0,125 кг = 0,05 моль/кг;
По закону Рауля понижение температуры кристаллизации без учета диссоциации электролита составляет:
Ткр = Kкр сm = 1,86 град/кг моль 0,05 моль/кг = 0,093 град.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, определяем изотонический коэффициент i:
i = Ткр.эксп. / Ткр.выч. = 0,23/0,093 = 2,47.
Зная изотонический коэффициент, можно найти кажущуюся степень диссоциации соли:
i | 1 | 2,47 | 1 | 0,735 | |
= n | 1 | 3 | 1 | ||
Ответ: = 0,735
Задача № 11
Какую массу сахарозы следует растворить в 250 г воды, чтобы получить раствор, кипящий при 100,2оС ?
Решение:
По II-му закону Рауля Ткип = Е сm(Х),
где Е – эбулиоскопическая константа воды, равная 0,52 град кг/моль, сm – моляльная концентрация неэлектролита сахарозы.
По условию Ткип = 100,2 – 100 = 0,2 град;
сm = | Tкип | 0,2 | 0,385 моль/кг ; |
Kэб | 0,52 | ||
33

сm(С12Н22О11) = | m(X) |
M (X) mр ля | |
m(сахарозы) = 0,385 моль/кг 342 г/моль
342 г/моль  0,25 кг = 32,9 г
0,25 кг = 32,9 г
Ответ: m(сахарозы) = 32,9 г
Задача № 12
Какова массовая доля глицерина в водном растворе, если он замерзает при
–0,52оС?
Решение:
Понижение температуры замерзания раствора
Тзам. = Тзам. р-ля Тзам. р-ра  Тзам. = 0оС ( 0,52оС) = 0,52оС.
Тзам. = 0оС ( 0,52оС) = 0,52оС.
По II-му закону Рауля Тзам = K(Н2О) сm(Х), тогда
сm(Х), тогда
cm = | Tзам | 0,52 град | = 0,28 моль/кг. |
K (H2O) | 1,86 кг град/моль | ||
Переход от моляльной концентрации к массовой доле осуществляется по формуле:
сm(Х) = | 1000 | = | cm (X) | (100 | ω) | M (X) | ; | |||||||
(100 | ω) | M (X) | 1000 | |||||||||||
0,28 (100 | ) 92 | 25,76 (100 ) | ; | |||||||||||
1000 | 1000 | |||||||||||||
= | 2576 25,76 | ; | 1000 | = 2576 – 25,76 | ; | = 2,51%. | ||||||||
1000 | ||||||||||||||
Ответ: массовая доля глицерина в водном растворе 2,51%.
Задача № 13
Рассчитайте осмотическое давление при 310 К 20%-ного водного раствора глюкозы ( = 1,08 г/мл), применяемого для внутривенного введения, например, при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что Росм крови равно
740–780 кПа?
Решение:
По закону Вант-Гоффа: Росм = с(Х)RT,
где с(Х) – молярная концентрация раствора; R –газовая постоянная, 8,31 Дж/(моль К); Т – абсолютная температура.
Переход от массовой доли к молярной концентрации осуществляется по формуле:
c(X) | ω ρ 10 | ; с(С6Н12О6) = | 20 1,08 10 | = 1,2 моль/л. |
M (X) | 180 | |||
Росм=1,2 103 моль/м3  8,31 Дж/моль 310 К = 3 091 320 Па = 3091,3 кПа.
8,31 Дж/моль 310 К = 3 091 320 Па = 3091,3 кПа.
34

Ответ: так как 3091,3 кПа Росм крови, то 20%-ный раствор глюкозы является гипертоническим.
Задача № 14
Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы
( = 1,006 г/мл)?
Решение:
Эритроциты в гипотонических растворах за счет эндоосмоса лопаются, происходит гемолиз, а в гипертонических растворах – сморщиваются (плазмолиз).
Осмотическое давление 2%-ного раствора глюкозы определяется по закону Вант-Гоффа:
Росм. = с(Х)RT, где c(X) | ω ρ 10 | ; | |||||
M (X) | |||||||
Pосм. | ω С6Н12О6 | ρ 10 | R Т | ||||
M С6Н12 | О6 | ||||||
Росм. | = | 2 1,006 10 | 103 моль/м3 8,31 Дж/(моль К) 310 К = 287951 Па = | ||||
180 | |||||||
287,951 кПа
Ответ: Росм 2%-ного раствора глюкозы меньше осмотического давления крови, поэтому с эритроцитами в таком растворе произойдет гемолиз.
Задача № 15
Осмотическое давление крови равно в норме 740-780 кПа. Вычислите осмолярность крови при 310 К.
Решение:
По уравнению Вант-Гоффа: Росм = с(Х) R T.
Pосм.
сосм(Х) = R  T ,
T ,
где сосм – осмолярная концентрация – это суммарное молярное количество всех кинетически активных, т.е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
сосм1 | = | 740000 Па | = 287,3 моль/м3 | = 0,287 осмоль/л; |
8,31 Дж/моль К 310 К | ||||
сосм2 | = | 780000 Па | = 302,8 моль/м3 | 0,303 осмоль/л. |
8,31 Дж/моль К 310 К
Ответ: осмолярность крови составляет 0,287–0,303 осмоль/л.
Задача № 16
35

При несахарном диабете выделяются большие объемы разбавленной мочи, осмолярность которой снижается до 0,06 осмоль/л. Вычислите осмотическое давление такой мочи при 310 К.
Решение:
Росм = с(Х) R T = 0,06 103 осмоль/м3  8,31 Дж/моль К
8,31 Дж/моль К  310 К=154566 Па = = 154,6 кПа.
310 К=154566 Па = = 154,6 кПа.
Ответ: осмотическое давление разбавленной мочи значительно ниже осмотического давления плазмы крови.
Задача № 17
Рассчитайте осмотическое давление 0,01 М раствора KCl, при Т = 310 К, если изотонический коэффициент (i) равен 1,96. Каким будет этот раствор по отношению к плазме крови?
Решение:
Для растворов электролитов в уравнение Вант-Гоффа вводится изотонический коэффициент (i) для учета электролитической диссоциации:
Росм = i с(Х) R T
Росм = 1,96 с(KCl) R T = 1,96 0,01 103 моль/м3 8,31 Дж/моль К 310 К = 50491,56 Па = 50,5 кПа.
Ответ: 0,01 М раствор гипотоничен плазме крови.
Задача № 18
В качестве слабительного средства взрослым назначают принимать натощак 0,5 стакана(100 мл) раствора глауберовой соли, содержащего 20 г Na2SO4 10H2O. Рассчитайте осмотическое давление этого раствора при 25 С и поясните механизм его действия (i = 2,75).
Решение:
По закону Вант – Гоффа для растворов электролитов
Росм(Х) = i с(Х) R T= i | m(Na 2SO 4 | 10H 2O) 1000 | RT ; | ||
M (Na 2SO 4 | 10H 2O) Vp pa | ||||
Росм= 2,75 | 20 1000 8,314 298 | =4231,88 кПа. | |||
322 100 | |||||
Ответ: раствор гипертоничен, т.к. его Росм больше 760 кПа, поэтому осмотическое давление в просвете кишечника повышается, вызывая тем самым поступление большого количества воды и послабляющее действие.
Задача № 19
При внутренних кровоизлияниях (легочных, желудочно-кишечных), а также для усиления диуреза внутривенно вводят от 5 до 20 мл 10%-ного раствора NaCl ( = 1,071 г/мл, i = 1,87). Рассчитайте осмотическое давле-
36

ние этого раствора и определите, каким он будет по отношению к плазме крови. (t = 37 С).
Решение:
с(NaCl) | 10 | 10 1,071 10 | = 1,83 моль/л | |
М | 58,5 | |||
Росм = iсRT = 1,87 1,83 8,314 310 = 8819,92 кПа
Ответ: раствор будет гипертоничен по отношению к плазме крови.
Задача № 20
Какова степень электролитической диссоциации ( ) дихлоруксусной кислоты в ее 0,01 М растворе, если при 300 К этот раствор создает осмотическое давление в 43596,4 Па?
Решение:
Так как СНСl2СООН – электролит, используется уравнение Вант-Гоффа в виде: Росм = i с(Х) R T.
Из этого уравнения i | с(X) R T ; | ||||||
Pосм | |||||||
i | 43596,4 Па | = 1,75. | |||||
0,01 103 моль/м3 | 8,31 Дж/моль К 300 К | ||||||
Степень диссоциации электролита определяется по формуле: | i | 1 | , | ||||
n | 1 | ||||||
где i – изотонический коэффициент;
n – число ионов, на которое распадается данный электролит;
1,75 1 = 0,75.
2 1
Ответ: степень диссоциации дихлоруксусной кислоты равна 0,75.
 Обучающие тесты
Обучающие тесты
1.Более сильный термический ожог может быть вызван кипящим сахарным сиропом с массовой долей сахарозы, равной:
1) 2% 2) 5% 3) 8% 4) 10%
Решение:
Согласно II закону Рауля повышение температуры кипения раствора по сравнению с растворителем рассчитывается по формуле:
Ткип = Е сm(Х),
где сm(Х)-моляльная концентрация растворѐнного вещества.
Между моляльной концентрацией и массовой долей существует математическая зависимость, из которой видно, что чем больше массовая доля
37

растворѐнного вещества, тем больше и моляльная концентрация этого вещества в растворе
сm(Х) = | 1000 |
(100 ω) M (X) . | |
Таким образом, самую высокую температуру кипения будет иметь раствор с массовой долей сахарозы, равной 10%, следовательно, этим раствром можно получить более сильный термический ожог.
Ответ: 4
2.Осмотическое давление сантимолярного раствора АlCl3 по сравнению с сантимолярным раствором NaCl будет ____________.
Решение:
NaCl и АlCl3 – электролиты, поэтому осмотическое давление растворов этих веществ рассчитывается по формуле
Росм = i с(Х) R T.
Между изотоническим коэффициентом i и степенью диссоциации существует математическая взаимосвязь: i = 1+ (n–1),
где n-число ионов, образующихся при ?


