Этиология патогенез подагра и как

Подагра – это болезнь, которая является разновидностью воспаления суставов и вызывается нарушением обмена веществ. Этот недуг сопровождается отложением солей уратов (соли мочевой кислоты) на различных тканях.
Медицинская история указывает на тот факт, что эта болезнь существовала еще во времена Гиппократа. Дословно название этого недуга переводится как «нога в капкане», и это вполне соответствует описанию симптомов подагрического приступа. Также эта болезнь была известна истории под названием «болезнь королей». Такое наименование недуга, которое бытовало в средние века, вызвано тем, что именно представители богатого сословия были неумеренными в еде и употреблении спиртного, и это приводило их к нарушению обмена веществ и отложению солей мочевой кислоты на суставных тканях.
В последние годы количество больных подагрой стало увеличиваться, и это объясняется тем, что население стало потреблять большее количество мясных продуктов, богатых пуринами, и алкогольных напитков. Стрессы, нерациональная организация своего режима труда и отдыха, – все эти атрибуты современности приводят к сбою в обмене веществ и возможному развитию синдрома гиперлипидемии, который является основным толчком в развитии подагры. По данным статистики, эта болезнь чаще наблюдается у мужчин среднего возраста. Также она может появляться и у женщин после наступления менопаузы.
В этой статье мы расскажем вам об этиологии и патогенезе подагры. Эти знания помогут вам предупредить развитие этой болезни, понять механизм развития этого недуга и вовремя обращать внимание на первые тревожные изменения в своем организме.
Этиология
Большинство врачей и ученых считают, что основной причиной подагры становится долго продолжающееся повышение уровня мочевой кислоты в крови. Привести к этому могут различные заболевания других систем организма и целый ряд предрасполагающих факторов. Именно поэтому врачам бывает достаточно сложно установить истинную первопричину недуга.
Наиболее вероятно развитие подагры при таких сопутствующих патологиях:
- синдром гиперлипидемии;
- хроническая алкогольная интоксикация;
- артериальная гипертензия;
- ожирение;
- псориаз;
- дефицит фермента ГГФТ;
- сахарный диабет;
- заболевания крови: гемолитическая анемия, лейкозы, лимфома;
- заболевания почек;
- прием некоторых лекарственных препаратов: Никотиновая кислота, Этамбутол, петлевые и тиазидные диуретики, салицилаты;
- повышенный уровень потребления продуктов с высоким уровнем пуринов: мясо, бобовые, икра, шоколад, кофеинсодержащие напитки.
Высокий уровень мочевой кислоты в крови может провоцироваться следующими причинами:
- в организм вместе с пищей поступает чрезмерное количество мочевой кислоты, и почки не могут справляться с ее выводом;
- в организм поступает нормальное количество мочевой кислоты, но почки, вследствие каких-либо патологий, не могут полностью ее выводить.
Патогенез
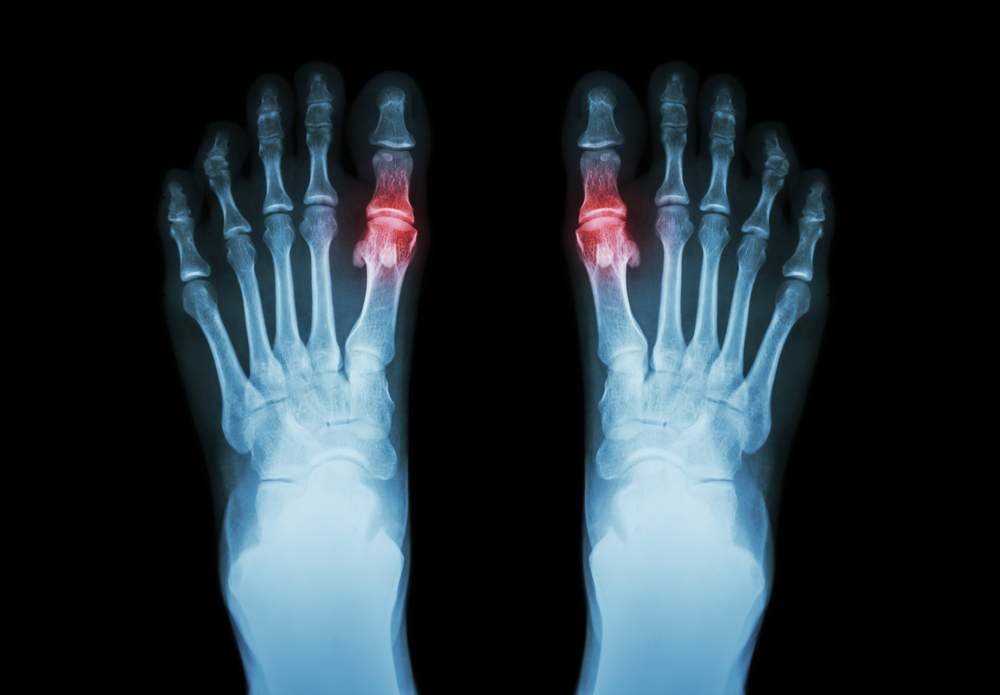
В процессе развития подагры выделяется три основные фазы:
- Накопление уратов в организме и повышение уровня мочевой кислоты в крови.
- Отложение солей уратного происхождения в тканях.
- Появление острого подагрического артрита и поражение почек.
Первая и вторая фазы
Накопление уратов происходит в виде отложения кристаллов игольчатой формы в бессосудистых тканях, т. е. в хрящах, связках, сухожилиях, периферических суставах и зонах, которые подвергаются наибольшему трению или охлаждению (локти, седалищные бугры и ушные раковины). При продолжительном течении подагры соли начинают накапливаться в более крупных суставах.
Третья фаза
Пусковым механизмом приступа подагрического артрита становится срабатывание «сторожевой полисистемы» полиморфно-ядерных лейкоцитов (в большей мере нейтрофилов) и плазмы крови на кристаллические отложения уратов. Взаимодействие этих факторов крови и солей мочевой кислоты приводит к образованию медиаторов воспаления и простагландинов. Это провоцирует воспаление в суставных и мягких тканях, которое проявляется симптомами артрита.
При прогрессировании подагры и отсутствии адекватной терапии кристаллы уратов накапливаются и в паренхиме почек. При накоплении этих солей в моче и кислых значениях ее pH происходит образование кристаллов, которые, разрастаясь, преобразовываются в небольшие конкременты и камни. Это может приводить к закупорке почечных канальцев и инкрустации уратов в эпителии. В зоне накопления кристаллов развивается некроз, который сопровождается периодами воспаления этих участков.
Такое развитие подагры в почках приводит к появлению подагрического и часто рецидивирующего пиелонефрита, который приводит к постепенному сморщиванию почечной ткани (т. е. к нефросклерозу). Параллельно с этими воспалительно-дегенеративными процессами, в почках образуются мелкие конкременты и камни, приводящие к развитию мочекаменной болезни. В дальнейшем подагрическое поражение приводит к формированию почечной недостаточности, что может становиться причиной смерти больного.
Телеканал ТВЦ, передача «Врачи» на тему «Подагра: причины, диагностика, лечение»:
Источник
Подагра (болезнь королей, пиратская болезнь, болезнь воскресного вечера и утром в понедельник) – хроническое метаболическое заболевание, связанное с нарушением пуринового обмена и накоплением в организме мочевой кислоты, клинически проявляющееся рецидивирующим артритом, образованием подагрических узлов (тофусов) и поражением внутренних органов.
Классификация подагры (по МКБ-10):
А) идиопатическая подагра
Б) свинцовая подагра
В) лекарственная подагра
Г) подагра, обусловленная нарушением почечной функции
Выделяют Первичную подагру (самостоятельное заболевание) И вторичную подагру (проявление других болезней – миелолейкоза, псориаза, ХПН, приема цитостатиков и др.
Этиология подагры:
1) причины, обуславливающие снижение экскреции мочевой кислоты (90%):
– генетически обусловленная гипофункция ферментных систем почек, регулирующих экскрецию мочевой кислоты
– дегидратация, склонность к кетоацидозу
– хроническая почечная недостаточность
– некоторые ЛС (салуретики, цитостатики)
– гипотиреоидизм и др.
2) причины, обуславливающие гиперпродукцию мочевой кислоты (10%):
– генетически обусловленное снижение активности гипоксантин-гуанинфосфорибозилтрансферазы и аденинфосфорибозил-пирофосфат-синтетазы, повышение активности 5-фосфорибозил-1-синтетазы
– миелопролиферативные заболевания (полицитемия, лейкозы)
– псориаз
– избыточное питание с преобладанием однообразной мясной пищи
– употребление определенных алкогольных напитков (особенно пива, сухих вин)
Патогенез подагры:
Дефекты энзимов обмена мочевой кислоты и др. этиологические факторы ® гиперпродукция мочевой кислоты и/или снижение ее экскреции ® гиперурикемия ® отложение уратов в тканях ®
А) активация уратовыми кристаллами в суставной полости фактора Хагемана, комплемента, кининов ® повышение сосудистой проницаемости, приток нейтрофилов, высвобождающих лизосомальные ферменты, цитокины ® острое подагрическое воспаление
Б) накопление уратовых кристаллов в интерстиции почек и канальцев ® подагрическая нефропатия и др.
Клиника подагры:
1. клиника типичного острого приступа подагры:
– начинается внезапно в любое время суток, но чаще ночью или рано утром (когда снижается скорость диффузии уратов в плазму)
– появляются резчайшие боли чаще всего в I плюснефаланговом суставе (болезненно даже прикосновение простыни)
– быстро нарастают местные симптомы воспаления, достигающие максимума через несколько часов: припухлость, отек, локальная гипертермия; кожа над суставов вначале гиперемирована, затем становится синевато-багровой, блестит, напряжена; характерно значительное ограничение подвижности сустава
– через 7-10 дней происходит полное спонтанное обратное развитие симптомов
2. проявления гиперурикемии (подагрического статуса):
– подкожные тофусы (подагрические узлы) – образуются при высокой гиперурикемии и длительности заболевания свыше 5-6 лет; представляют собой узелки желтоватого цвета, содержащие ураты, окруженные соединительной тканью; локализуются чаще всего на ушных раковинах, локтях, в бурсах локтевых суставов, стопах, на пальцах кистей, разгибательной поверхности предплечья; содержимое тофусов белого цвета, при приступах может разжижаться и выделяться через свищи (нагноения не характерны, т. к. ураты обладают бактерицидным эффектом)
– уролитиаз и нефролитиаз – мочекаменная болезнь (клиника почечной колики или присоединившегося пиелонефрита, подагрическая нефропатия (подагрический интерстициальный нефрит) с исходом в ХПН
– поражение клапанного аппарата сердца
Стадии естественного прогрессирующего течения подагры:
А) острый подагрический артрит – клиника острого приступа
Б) межприступная подагра – период между атаками падагры, когда больной не предъявляет жалоб; без адекватной терапии постепенно укорачивается
В) хроническая тофусная подагра – клиника подагрического статуса.
Диагностические критерии подагры:
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости и/или
Б. Тофус, подтвержденный химическим анализом или поляризационной микроскопией и/или
С. Наличие 6 из 12 клинических, лабораторных, рентгенологических признаков:
1) максимум интенсивности воспаления в первый день
2) наличие более чем одной атаки артрита
3) моноартрит
4) покраснение сустава
5) боль и воспаление плюснефалангового сустава первого пальца
6) симметричное воспаление плюснефалангового сустава
7) одностороннее поражение суставов тыла стопы
8) подозрение на тофусы
9) гиперурикемия
10) асимметричное воспаление суставов
11) субкортикальные кисты без эрозий при рентгенологическом обследовании
12) отсутствие микроорганизмов в культуре синовиальной жидкости
Диагностика подагры:
1. Лабораторные данные:
А) ОАК: во время приступа – нейтрофильный лейкоцитоз со сдвигов влево, повышение СОЭ
Б) БАК: в периоде обострения – повышение серомукоида, фибрина, гаптоглобина, сиаловых кислот, a2- и γ-глобулинов, мочевой кислоты (повышается не во время острого приступа, а в межприступный период; в норме 0,12-0,24 ммоль/л)
В) ОАМ: при подагрической нефропатии: изостенурия, микрогематурия, протеинурия, цилиндрурия
2. Инструментальные исследования:
А) рентгенография суставов – выявляет изменения при хроническом подагрическом артрите; изменения суставов и эпифизов в виде круглых «штампованных» очагов просветления различного диаметра (из-за костных тофусов); симптом «вздутия костного края» – разрушение коркового вещества кости увеличенными узлами; возможно полное разрушение эпифизов и замещение их уратными массами (в далеко зашедших случаях заболевания)
Б) исследование синовиальной жидкости: прозрачная, вязкость не изменена или снижена, лейкоцитов 1-15*109/л, гранулоцитов 25-75%, кристаллы урата натрия
В) пункционная биопсия тофусов – обнаружение кристаллов мочевины
Лечение подагры:
1. Диета № 6: ограничение пуринов (сардин, анчоусов, печени, жирного мяса), жиров, исключение алкогольных напитков, увеличение объема выпиваемой жидкости до 2-3 л/сут.
2. Купирование острого подагрического приступа:
а) покой пораженного сустава, прохладные компрессы
б) колхицин по 0,5 мг каждый час до купирования приступа, но не более 6-8 мг/сут (не более 1 дня)
в) НПВС (индометацин, диклофенак) в высоких дозах 3-5 дней, при уменьшении боли доза снижается
г) УФО суставов, УВЧ, калий-литиевый электрофорез на сустав, аппликации димексида
NB! Нельзя применять урикостатики и уриколитики, т. к. колебания концентрации мочевой кислоты способны пролонгировать приступ подагры.
3. Лечение в межприступном периоде:
а) урикостатики – блокируют образование мочевой кислоты: аллопуринол, начальная доза 100 мг/сут с постепенным увеличением ее до 300 мг/сут за 3-4 недели
б) уриколитики – усиливают выведения мочевой кислоты: пробенецид по 250 мг 2 раза/сут 1 неделю, затем по 500 мг 2 раза/сут (противопоказнаы при МКБ, подагрическом нефрите)
в) препараты комбинированного действия (урикостатик+уриколитик): алломарон по 1 таб 1 раз/сут
г) фонофорез с гидрокортизоном, теплолечение, бальнеолечение
4. Санаторно-курортное лечение показано только в фазе ремиссии при сохраненной функции суставов (грязелечение, лечебное питание, щелочные минеральные воды, бальнеотерапия – радоновые, сероводородные ванны).
Источник
Этиология подагры.
Детерминирующим фактором риска развития подагры является содержание уратов в плазме. Под гиперурикемией понимают концентрацию уратов в сыворотке выше 7,0 мг/дл (или 0,42 ммоль/л) у мужчин и выше 6,0 мг/дл (или 0,36 ммоль/л) у женщин.
Значительная агрегация подагры и гиперурикемии у родственников свидетельствует о значении генетических факторов в предрасположенности к этому заболеванию. Так, например, в Японии описано шесть поколений японской семьи с подагрическим артритом и прогрессирующей нефропатией (Yokota N. [et al.], 1991). Имеются сведения о существовании слабой ассоциации подагры с HLA-B14 (В. Casstum [et al.], 1994).
Используя молекулярно-генетические методы исследования, было выявлено
ингибирование репаративного синтеза ДНК при воздействии мутагенов УФ-типа у больных подагрой. Выявленные изменения сохранялись в перевиваемых клеточных линиях фибробластов у пациентов с нарушением пуринового обмена. В подтверждение роли генетических факторов при подагре можно привести и данные Nicklas J., который показал, что ген, ответственный за гипоксантин-гуанин-фосфорибозилтрансферазу, находится на длинном рукаве Х-хромосомы (Xq 26).
Запасы мочевой кислоты в организме в норме составляют 1000 мг при скорости их обновления в пределах 650 мг/сут. Нарушение обмена пуринов может приводить к повышению уровня мочевой кислоты в крови. Источником образования мочевой кислоты в организме являются пуриновые соединения, поступающие с пищей, а также образующиеся в организме в процессе обмена нуклеотидов.

Метаболизм пуриновых нуклеотидов. ГГФТ — гипоксантингуанинфосфорибозил-трансфераза; АФТ — аденинфосфорибозилтрансфераза; АТФ — аденозинтрифосфат; ФРПФ — фосфорибозилпирофосфат
Метаболизм пуриновых оснований регулируется несколькими ферментами. В настоящее время доказано наличие двух ферментативных дефектов, сопровождающихся усилением синтеза мочевой кислоты и развитием подагры в детском или подростковом возрасте. Речь идет о дефиците гипоксантингуанинфос-форибозилтрансферазы (ГГФТ) и повышенной активности фосфорибозилпиро-фосфатсинтетазы (ФРПФ-синтетаза). Данные ферменты контролируются генами, связанными с Х-хромосомой. Повышенное внутриклеточное разрушение АТФ (с образованием большого количества аденина), наблюдаемое при врожденных (гликогенозы, непереносимость фруктозы) и приобретенных заболеваниях и состояниях (гипоксемия, физическая нагрузка, злоупотребление алкоголем), также может приводить к гиперурикемии. Полный дефицит ГГФТ наряду с развитием подагрического артрита приводит к выраженным психоневрологическим нарушениям: умственной отсталости, аутоагрессивности, хореоатетозу. Данный симптомокомплекс получил название синдрома Леша — Найхана.
В норме процессы синтеза мочевой кислоты и ее выделения сбалансированы. Но при каком-либо нарушении этого процесса повышается содержание мочевой кислоты в сыворотке крови: развивается гиперурикемия.
Подробный перечень факторов, способствующих гиперурикемии, приводит в своей работе Дж. Скотт (1990):
1) факторы, обусловливающие повышенное образование мочевой кислоты:
- специфические ферментные дефекты;
- снижение активности гипоксантингуанинфосфорибозилтрансферазы;
- повышение активности фосфорибозилпирофосфатсинтетазы;
- усиление обмена нуклеотидов;
- характер питания и др.;
2) факторы, обусловливающие замедление выведения мочевой кислоты:
- нарушение функции почек;
- лекарственные препараты;
- накопление кетоновых соединений;
- артериальная гипертензия;
3) другие факторы:
- раса;
- пол;
- возраст;
- нарушение липидного обмена;
- алкоголь.
Патогенез подагры.
Процессы отложения солей мочевой кислоты в тканях определяют клинические проявления подагры. Механизм отложения уратов до конца не выяснен. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и наличие субстанций, удерживающих ураты в жидкости, — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0-13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
Образование кристаллов уратов натрия рассматривается как основной патологический процесс при подагрическом артрите. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и присутствие или отсутствие субстанций, удерживающих ураты в жидкости, главным образом протеогликанов. Концентрация уратов в синовиальной жидкости, как правило, близка к их плазменному и тканевому содержанию, но может нарастать, если в силу каких-то причин содержание воды, например в суставе, уменьшается. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что, в свою очередь, способствует их кристаллизации. Предполагается, что на последний процесс влияет и концентрация других катионов, таких как кальций и натрий.
Одновременно в результате метаболической активности нейтрофилов в синовиальной жидкости происходит снижение рН, что ведет к дальнейшему осаждению кристаллов уратов. Наиболее ярким проявлением этого процесса является острый подагрический артрит.
Еще в 1961 г. D. McCarty и J. Hollander установили, что острый приступ артрита развивается вследствие выпадения микрокристаллов урата натрия в полость сустава. М. Cohen и В. Emmerson (1994) полагают, что острая атака подагры ассоциируется с образованием кристаллов, а не с выходом последних из ранее образованных депозитов в субсиновии. Кристаллы уратов способны инициировать интенсивную атаку острого воспаления, так как обладают способностью стимулировать высвобождение различных медиаторов воспаления, таких как С5а, брадикинин, а также ИЛ-1, ИЛ-6 и ИЛ-8, ФНО и кислородные радикалы.

Патогенез подагрического артрита
Именно эти цитокины провоцируют приток нейтрофилов в полость сустава. Описывая воспалительную реакцию при подагре, авторы подчеркивают, что кристаллы, покрытые протеином (IgG), через реакцию с Fc-рецепторами на поверхности клеток обеспечивают фагоцитоз с образованием фаголизосом. Фаголизосо-мальные энзимы удаляют IgG с поверхности кристаллов, а водородные соединения индуцируют лизис мембран. В результате высвобождаются протеолитические ферменты лизосом, происходит секреция радикалов кислорода, простагландинов, лейкотриенов и других медиаторов воспаления. Кристаллы уратов являются активаторами комплемента, они активируют фактор Хагемана и каскад кининов.
Таким образом, активация калликреиновой и кининовой систем, увеличение проницаемости сосудистой стенки, активация системы комплемента, усиливая хемотаксис лейкоцитов к кристаллам уратов, поддерживают воспалительный процесс. В очаге воспаления снижается рН среды, что способствует еще большей кристаллизации уратов. Создается патогенетический порочный круг.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятно, связаны с синтезом «антивоспалительных» медиаторов (рецепторный антагонист ИЛ-1, ТФР-β).
Патоморфология подагры.
Отложения уратов выявляются преимущественно в тканях суставов (синовиальной мембране, хряще, эпифизах костей, капсуле), околосуставных тканях (сухожилиях, связках). Гистопатологические изменения, наблюдаемые в синовиальной оболочке, включают отложения фибрина, пролиферацию синовиальных клеток и выраженную инфильтрацию нейтрофильными лейкоцитами.
Острый подагрический артрит характеризуется наличием кристаллов уратов в поверхностном слое синовиальной мембраны. Уратные кристаллы при остром артрите, как правило, находятся внутри фагоцитирующих клеток синовиальной жидкости; в составе клеточных инфильтратов преобладают нейтрофилы.
При хронической подагре поражение суставов характеризуется значительной деструкцией хряща, изменениями сухожилий, связок и синовиальных сумок, нередко выявляется и субхондральное нарушение целостности кости. При этой форме подагры происходит образование тофусов и поражение внутренних органов.
В тофусах отмечается большое скопление кристаллов уратов, окруженное гранулематозной тканью, в составе которой обнаруживаются гигантские гранулематозные многоядерные клетки. С течением времени тофусы могут кальцифицироваться, оссифицироваться.
Среди внутренних органов наиболее выраженные изменения наблюдаются в почках. Отложения уратов обнаруживают в интерстициальной ткани, в клубочках, в просвете канальцев и их стенках, в чашечках и лоханках. В интерстиции выявляется гигантоклеточная и лейкоцитарная воспалительная реакция. Изменения в клубочках (утолщение петель капилляров, умеренные клеточные инфильтраты преимущественно на периферии петель) непосредственно не связаны с отложением уратов, а являются вторичными. Возможно увеличение мезангиального матрикса, реже наблюдается мезангиальная пролиферация. В сосудах встречаются изменения типа артерио- и артериолосклероза, которые коррелируют с выраженностью тубулярной атрофии.
Несмотря на то что увеличение уровня мочевой кислоты является фактором риска, у многих больных с выраженной гиперурикемией подагра не развивается. Следовательно, в развитии подагры наряду с гиперурикемией имеют значение и другие факторы, требующие дальнейшего изучения.
Болезни суставов
В.И. Мазуров
Источник


