Клиническая рекомендация по диагностике подагре


Версия: Клинические рекомендации РФ (Россия) 2013-2017
Категории МКБ:
Подагра (M10)
Разделы медицины:
Ревматология
Общая информация
Краткое описание
Общероссийская общественная организация Ассоциация ревматологов России
Федеральные клинические рекомендации «Подагра»
Клинические рекомендации «Подагра» прошли общественную экспертизу, согласованны и утверждены 17 декабря 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности «ревматология». (Президент АРР, академик РАН — Е.Л.Насонов)
Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия (МУН) и развивающимся в связи с этим воспалением у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами.
Общая характеристика болезни
Основные клинические проявления подагры: рецидивирующие атаки острого артрита, накопление кристаллов уратов в тканях с образованием тофусов, нефролитиаз, подагрическая нефропатия.
В развитии подагры выделяют 3 стадии:
— острый подагрический артрит
— периоды между приступами подагрического артрита (межприступная подагра)
— хроническая тофусная подагра.
Мобильное приложение «MedElement»
— Профессиональные медицинские справочники. Стандарты лечения
— Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»
— Профессиональные медицинские справочники
— Коммуникация с пациентами: вопросы, отзывы, запись на прием
Скачать приложение для ANDROID / для iOS
Классификация
Классификационные критерии, принципы диагностики подагры
Для диагностики подагрического артрита в 1975 году Американской Ассоциацией Ревматологов (ААР) были рекомендованы предварительные классификационные критерии, одобренные ВОЗ в 2002 году.
Классификационные критерии острого подагрического артрита
А. Наличие характерных кристаллов мочевой кислоты в суставной жидкости
Б. Наличие тофусов, содержание кристаллов мочевой кислоты, в которых подтверждено химически или поляризационной микроскопией
В. Наличие 6 из 12 ниже перечисленных признаков:
1. Более одной атаки острого артрита в анамнезе
2. Воспаление сустава достигает максимума в 1-й день болезни
3. Моноартрит
4. Гиперемия кожи над пораженным суставом
5. Припухание и боль в первом плюснефаланговом суставе
6. Одностороннее поражение первого плюснефалангового сустава
7. Одностороннее поражение суставов стопы
8. Подозрение на тофусы
9. Гиперурикемия
10. Асимметричный отек суставов
11. Субкортикальные кисты без эрозий (рентгенография)
12. Отрицательные результаты при посеве синовиальной жидкости
Диагностика
Клиническая характеристика основных симптомов подагры.
Демонстрация кристаллов моноурата натрия (МУН) в синовиальной жидкости или в содержимом тофуса позволяет поставить определенный диагноз подагры (уровень доказательности IIb). Специфичность метода поляризационной микроскопии для демонстрации кристаллов крайне высока.
Основным клиническим проявлением, который позволяет заподозрить подагру является острый артрит. Острая атака с быстрым развитием выраженной боли и воспаления, которые достигают максимума в течение 6-12 часов, особенно сопровождающиеся эритемой, высоко подозрительны в отношении микрокристаллического воспаления, хотя не специфичны для подагры (уровень доказательности IIb).
Рутинный поиск кристаллов рекомендуется в любой синовиальной жидкости, полученной из воспаленного сустава у больных с отсутствием определенного диагноза (уровень доказательности IV).
Пунктировать суставы в диагностических целях можно и в межприступный период. Идентификация кристаллов МУН из невоспаленного сустава обеспечивает определенный диагноз в межприступном периоде (уровень доказательности IIb).
Подагра и сепсис могут сосуществовать, поэтому при подозрении на септический артрит окраска по грамму и исследования культуры синовиальной жидкости должны выполняться даже в случае идентификации кристаллов МУН (уровень доказательности IIb). Гораздо чаще септического артрита развиваются нагноения мягких тканей в области вскрывшихся подкожных тофусов.
Несмотря на то, что ГУ является наиболее важным фактором риска подагры, сывороточный уровень МК не является фактором исключения или подтверждения подагры: многие люди с ГУ не развивают подагры, а во время острой атаки сывороточный уровень МК может быть нормальным (уровень доказательности Ib).
Почечная экскреция мочевой кислоты должна определяться у некоторых больных подагрой, имеющих семейную историю подагры с ранним началом, начало подагры ранее 25 лет, с анамнезом МКБ (уровень доказательности IIb).
Рентгенологическое исследование суставов помогает в проведении дифференциального диагноза и может демонстрировать типичные признаки хронической подагры, но бесполезно в ранней диагностике подагры (уровень доказательности IIb). Формирование внутрикостных тофусов часто происходит одновременно с подкожными тофусами, в связи с чем, рентгенологическое исследование используется для определения тяжести тофусного поражения. В действительности, при остром подагрическом артрите, рентгенологические изменения не всегда могут быть полезны для постановки диагноза подагры. Тем не менее, в ряде ситуаций выполнение рентгенограмм вполне оправдано для проведения дифференциального диагноза с травмами и т.д.
Факторы риска подагры и сопутствующие болезни должны выявляться, включая признаки метаболического синдрома (ожирение, гипергликемия, гиперлипидемия, гипертензия) (уровень доказательности Ia или Ib для отдельных факторов).
Лечение
Лечение подагры
Общие рекомендации
1. Оптимальное лечение подагры требует комбинации нефармакологических и фармакологических подходов (уровень доказательности Ib) и должно учитывать:
а) специфические факторы риска (уровень мочевой кислоты, количество предшествующих атак, рентгенография) (уровень доказательности IIb)
б) стадию болезни (асимптоматическая гиперурикемия, острый/интермиттирующий артрит, межприступный период, хроническая тофусная подагра) (уровень доказательности Ib)
в) общие факторы риска (возраст, пол, ожирение, гиперурикемические препараты, сопутствующие, полипрагмазия) (уровень доказательности Ib).
2. Обучение больного правильному образу жизни (уменьшение веса тела при ожирении, диета, уменьшение приема алкоголя, особенно пива) — ключевой аспект лечения. Ограничение в пищевом рационе богатых пуринами продуктов животного происхождения и снижение массы тела способствует снижению сывороточного уровня мочевой кислоты (уровень доказательности IIb), а алкоголь, особенно пиво, является независимым фактором риска для подагры (уровень доказательности III).
3. Гиперлипидемия, гипертензия, гипергликемия, ожирение и курение должны выявляться в каждом случае, т.к. являются важными компонентами при ведении больного с подагрой (уровень доказательности Ib).
Лечение острого приступа подагрического артрита
1. НПВП и колхицин могут быть эффективны в терапии острого приступа артрита (уровень доказательности Ib) и являются первой линией терапии. Данные о сравнительной эффективности НПВП и колхицина отсутствуют и при отсутствии противопоказаний, следует считать рациональным назначение НПВП.
2. Высокие дозы колхицина приводят к побочным эффектам, а низкие дозы (например 0,5 мг 3 раза в день) могут быть достаточны у ряда пациентов (уровень Ib).
3. Удаление синовиальной жидкости (уровень доказательности IV) и введение внутрисуставно длительно действующих глюкокортикоидов (уровень доказательности IIb) может быть эффективным и безопасным лечением острого приступа артрита.
4. При наличии противопоказании и/или неэффективности НПВП, колхицина и глюкокортикоидов для купирования острого приступа возможно применение препаратов, блокирующих интерлейкин-1 (уровень доказательности Ib).
Антигиперурикемическая терапия.
1. Антигиперурикемическая терапия показана больным с персистирующей гиперурикемией и острыми атаками, артропатией, тофусами или рентгенологическими изменениями. Проведение антигиперурикемической терапии показано в указанных случаях при неэффективности нефармакологических методов лечения. Решение о подобной терапии должно быть принято индивидуально, учитывать баланс между пользой и потенциальными рисками и согласовано с больным (уровень доказательности IV).
2. Целью антигиперурикемической терапии является предупреждение образование и растворение имеющихся кристаллов моноурата натрия, это достигается поддержанием уровня МК ниже точки супернасыщения сыворотки уратами (<360 мкмоль/л), так как предотвращение образования и растворении уже имеющихся кристаллов моноурата натрия, возможно при достижении указанного сывороточного уровня мочевой кислоты (уровень доказательности III).
3.Аллопуринол – эффективное средство для долгосрочного медикаментозного лечения у больных с хронической подагрой (уровень доказательности Ib). Назначение аллопуринола – реальная возможность проведения адекватной длительной антигиперурикемической терапии. При этом эффект в отношении снижения сывороточного уровня мочевой кислоты дозозависимый (уровень доказательности IIb).
Препарат должен быть назначен в исходно низкой дозе (100 мг ежедневно) с последующим увеличением (при необходимости) по 100 мг каждые две-четыре недели, что особенно важно у больных с почечной недостаточностью (уровень IV). При наличии почечной недостаточности доза должна быть подвергнута коррекции.
В случае развития побочных эффектов, связанных с применением аллопуринола, возможно назначение других ингибиторов ксантиноксидазы, урикозуриков. Проведение десенсибизизации к аллопуринолу возможно только при умеренных кожных проявлениях аллергической реакции (уровень доказательности IV).
4. Урикозурические агенты (пробенецид, сульфинпиразон) могут применяться как альтернатива аллопуринолу у пациентов с нормальной функцией почек, но относительно противопоказаны больным с уролитиазом. Эффект в отношении снижения сывороточного уровня мочевой кислоты, меньше, чем у аллопуринола (уровень доказательности IIa). Они не должны использоваться в пациентах со сниженной функцией почек (уровень доказательности IIb).
Бензбромарон может применяться у больных с мягкой и умеренной почечной недостаточностью у некоторых больных, но требует контроля в связи с риском гепатотоксичности (уровень доказательности Ib).
5. Профилактика суставных атак в течение первых месяцев антигиперурикемической терапии может достигаться колхицином (0,5-1,0 грамм в день) (уровень доказательности Ib) и/или НПВП (с гастропротекцией при показании) (уровень доказательности IIa). И колхицин и НПВП имеют потенциально серьезные побочные эффекты и их назначение предопределяет необходимость соотнести потенциальные пользу и вред.
При наличии противопоказании и/или неэффективности НПВП и колхицина для профилактики приступов артрита в первые месяцы антигиперурикемической терапии возможно назначение ингибиторов интерлейкина-1 (уровень доказательности Ib).
6. У больных с подагрой прием диуретиков по возможности отменяют (уровень доказательности IV), но это не касается случаев, когда диуретики назначены по жизненным показаниям. В качестве альтернативы могут быть использованы другие гипотенивные препараты.
Лозартан (уровень доказательности IIb) и фенофибрат (уровень доказательности Ib) имеют умеренный урикозурический эффект, что позволяет их применять у больных резистентных или плохо переносящих аллопуринол или урикозоурики, при наличии гипертензии или МС. Клиническое значение такой терапии и ее рентабельность пока неизвестны.
Информация
Источники и литература
- Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Информация
Методология
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций является глубина публикаций вошедших в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 20 лет.
Методы, использованные для оценки качества и глубины доказательств:
· Консенсус экспертов
· Оценка значимости в соответствии с рейтиноговой схемой
Рейтиноговая схема для оценки силы рекомендаций
| Сила | Описание |
| Ia | Мета-анализ рандомизированных контролируемых исследований |
| Ib | Рандомизированное контролируемое исследование |
| IIa | Контролируемое исследование без рандомизации |
| IIb | Квази-экспериментальное исследование |
| III | Неэкспериментальные описательные исследования, таких как сравнительные, корреляционные и исследования случай-контроль |
| IV | Сообщения или мнения экспертных комитетов или клинический опыт |
Описание метода валидизации рекомендаций
Данные рекомендации в проектной версии были рецензированы независимыми экспертами с целью их адаптации для врачей ревматологов и врачей первичного звена.
Комментарии, полученные от экспертов систематизировались и обсуждались членами рабочей группы, внесенные изменения регистрировались для каждого пункта рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества предложенных рекомендаций они были повторно проанализированы членами рабочей группы, которые пришли к заключении, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок сведен к минимуму.
Прикреплённые файлы
Внимание!
Если вы не являетесь медицинским специалистом:
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Источник
Автор:
Якупова С.П.
1
1 ФГБОУ ВО «Казанский ГМУ» Минздрава России
В последние несколько десятилетий отмечается рост заболеваемости подагрой. Несмотря на активное развитие новых направлений диагностики данного заболевания, постановка этого диагноза вызывает трудности. Возможно, это связано с недостаточной оснащенностью медучреждений в регионах необходимым оборудованием (поляризационный микроскоп, ультразвуковая диагностика поражения суставов, двухэнергетическая компьютерная томография) и/или наличием подготовленных специалистов. В этих случаях важным является разработка клинических критериев с более высокими показателями чувствительности и специфичности, позволяющих диагностировать подагру. В 2015 г. Европейской антиревматической лигой (EULAR) и Американским колледжем ревматологов (ACR) предприняты попытки разработать такие критерии, а в 2016 г. различными медицинскими сообществами (Американским колледжем врачей (ACP) и EULAR) выработаны стратегии ведения таких пациентов в клинической практике. Кроме того, в 2016 г. в Российской Федерации зарегистрированы новые препараты для лечения подагры (колхицин, фебуксостат). Важным является внедрение алгоритма этих рекомендаций в работу врачей, к которым обращаются пациенты с подагрой: ревматологов, травматологов, хирургов, терапевтов, врачей общей практики. На примере реального клинического случая в статье разбираются алгоритм постановки диагноза, стратегические направления лечения этих пациентов, принципы выбора лекарственных препаратов, роль нимесулида в терапии пациентов с подагрой.
Ключевые слова: подагра, подагрический артрит, критерии диагностики, принципы терапии, нимесулид.
Для цитирования: Якупова С.П. Алгоритм ведения пациентов с подагрой в свете современных рекомендаций. РМЖ. Медицинское обозрение. 2017;1:53-56.
Algorithm for gouty patients management in light of modern guidelines
Yakupova S.P.
Kazan State Medical University
In the past few decades, there has been an increase in the gout incidence rate. Despite the active development of new directions in the diagnosis of this disease, the formulation of this diagnosis is difficult. Perhaps this is due to insufficient equipment in the regions (polarizing microscope, ultrasound diagnosis of joints lesion, dual energy computed tomography) and / or trained specialists. In these cases, it is important to develop clinical criteria with higher sensitivity and specificity indicators that allow diagnosing gout. In 2015, the European Anti-Rheumatic League (EULAR) and the American College of Rheumatology (ACR) have attempted to develop such criteria, and in 2016 various medical communities (American College of Physicians (ACP) and EULAR) have developed strategies for managing such patients in clinical practice. In addition, in 2016 new drugs for the treatment of gout (colchicine, febuksostat) were registered in the Russian Federation. It is important to implement the algorithm of these guidelines in the work of doctors, who treat patients with gout, — rheumatologists, traumatologists, surgeons, therapists, general practitioners. On an example of a real clinical case, the article deals with the algorithm of diagnosis, the strategic directions of treatment of these patients, the principles of drug choice, the role of nimesulide in the therapy of gouty patients.
Key words: gout, gouty arthritis, diagnostic criteria, principles of therapy, nimesulide.
For citation: Yakupova S.P. Algorithm for gouty patients management in light of modern guidelines // RMJ. MEDICAL REVIEW. 2017. № 1. P. 53–56.
В статье приведен алгоритм ведения пациентов с подагрой в свете современных клинических рекомендаций. На примере реального клинического случая разбираются алгоритм постановки диагноза, стратегические направления лечения пациентов, принципы выбора лекарственных препаратов, роль нимесулида в терапии пациентов с подагрой.
Распространенность подагры составляет 1–4% от общей численности населения. Увеличению этого показателя способствуют неправильное питание, отсутствие физических упражнений, увеличение числа случаев ожирения и метаболического синдрома [1]. В последние несколько лет пересмотрены рекомендации по диагностике и лечению этого заболевания Европейской антиревматической лигой (EULAR, 2016) [2], Американским колледжем врачей (ACP, 2016) [3], рассмотрены новые классификационные критерии подагры (ACR/EULAR, 2015) [4]. Но, несмотря на наличие новых методов диагностики, эффективных методов лечения, подагра все еще часто диагностируется неверно, а подходы к лечению не являются оптимальными [2]. Рассмотрим на примере клинического случая алгоритм диагностики и лечения пациента с подагрой.
Пациент С., 44 года. Обратился с жалобами на сильную боль, припухлость и покраснение в правом 1 плюснефаланговом суставе, невозможность ходить из-за боли, болезненность при прикосновении. Данные жалобы беспокоят в течение последней недели. Принимает диклофенак 100 мг/сут с незначительным эффектом, местно использует нестероидные противовоспалительные препараты (НПВП) – мази.
В анамнезе: в течение 15 лет суставной синдром, преимущественно в 1 плюснефаланговом суставе, около 3 эпизодов острых артритов в год. Принимает НПВП – диклофенак, Найз.
Достоверный диагноз подагры такому пациенту можно выставить после проведения пункции сустава и обнаружения кристаллов моноурата натрия (МУН) в полученной синовиальной жидкости. Исследование синовиальной жидкости нужно проводить как можно скорее, лучше в течение 6 ч. Хотя можно исследовать и в течение 24 ч, если хранить образец при температуре 4°C [1]. К сожалению, поляризационная микроскопия, позволяющая идентифицировать кристаллы МУН, используется крайне редко, чаще всего из-за отсутствия необходимого оборудования.
Согласно новым классификационным критериям диагностики подагры ACR/EULAR 2015 г. (табл. 1), в случае отсутствия достоверного критерия может использоваться набор других критериев этого заболевания, выраженный в баллах (Шаг 3).
Для правильной постановки диагноза нужно собрать анамнез с детализацией характера течения артритов, локализации поражения; тщательное объективное обследование для выявления образований, подозрительных на тофусы; провести лабораторное обследование для выявления сывороточного уровня мочевой кислоты (МК); использовать доступные методы визуализации для подтверждения диагноза: ультразвуковое исследование (признак двойного контура), рентгенографию суставов (к сожалению, выявляет изменения на более поздней стадии болезни) или двухэнергетическую компьютерную томографию.
При осмотре пациента тофусов не выявлено, но пациент описал ранее наблюдаемые образования на ушах, которые самостоятельно вскрывались с мелоподобным содержимым. В анализе крови СОЭ – 35 мм/ч. Уровень МК – 0,58 мкмоль/л.
На рентгенограмме стоп в прямой проекции (рис. 1): крупные кисты в субхондральной зоне плюсневых и проксимальных фаланг 1-х пальцев правой и левой стоп и эрозии на суставных поверхностях – у пациента имеется длительный анамнез (15 лет) острых рецидивирующих артритов. 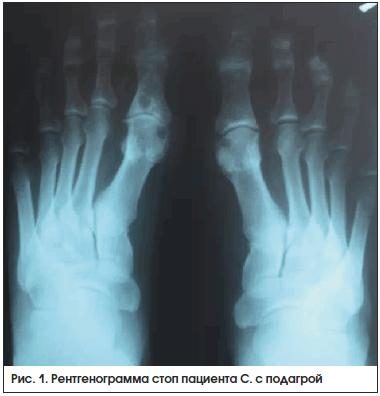
В представленном клиническом случае выявлены типичные симптомы артрита первого плюснефалангового сустава (2 балла); наличие трех критериев, характерных особенностей симптомов приступа (3 балла); повторяющиеся типичные приступы с наличием ≥2 признаков (2 балла); в анамнезе признаки тофусов на ушах (4 балла); лабораторно – повышение сывороточного уровня МК 0,48–<0,60 ммоль/л (3 балла); на рентгенографии стоп имеются эрозии (4 балла). Общее количество баллов – 18 (для достоверного диагноза необходимо 8).
В рекомендациях EULAR 2016 г. по диагностике и лечению подагры отмечена важность систематического обследования пациентов с подагрой для выявления сопутствующих заболеваний и факторов кардиоваскулярного риска (почечная недостаточность, ишемическая болезнь сердца, сердечная недостаточность, инсульт, атеросклероз периферических артерий, ожирение, гиперлипидемия, артериальная гипертония (АГ), сахарный диабет и курение). Коррекция выявленных изменений является неотъемлемой частью лечения пациентов с подагрой.
Пациент курит. Повышен индекс массы тела (ИМТ) – 31,25 кг/м2. Иногда отмечает повышение АД до 150/90 мм рт. ст., антигипертензивные препараты постоянно не принимает. Креатинин – 70,2 мкмоль/л, скорость клубочковой фильтрации (СКФ) (по CKD-EPI) – 109 мл/мин. Общий холестерин – в норме, повышение уровня триглицеридов, снижение уровня липопротеидов высокой плотности (ЛПВП). Риск по SCORE – 2%.
Пациенту даны рекомендации по соблюдению гиполипидемической и гипоурикемической диеты, исключению курения, снижению массы тела, контролю АД (препаратом выбора является лозартан).
Лечение острого артрита при подагре заключается в как можно более раннем назначении эффективного и безопасного для конкретного пациента противовоспалительного препарата (колхицин, НПВП, пероральные кортикостероиды или внутрисуставные кортикостероиды после аспирации синовиальной жидкости). На выбор терапии могут повлиять время от начала приступа, наличие противопоказаний к какому-либо из перечисленных препаратов, предшествующий опыт применения препаратов, а также число и тип суставов, вовлеченных в процесс.
В течение 12–24 ч от начала приступа рекомендуемым препаратом первого выбора для лечения приступа острого подагрического артрита может быть колхицин.
Но пациента симптомы артрита беспокоят уже в течение последней недели.
В анамнезе у больного имеется опыт эффективного приема диклофенака и нимесулида (Найз), при последнем обострении отмечается недостаточная эффективность диклофенака. Возможно ли в этом случае рекомендовать в качестве препарата для купирования текущего обострения и для раннего начала лечения артрита при будущих обострениях препарат нимесулид (Найз)?
Нимесулид имеет следующие особенности фармакокинетики, позволяющие его рекомендовать как препарат выбора при остром и хроническом болевом синдроме: хорошая биодоступность, быстрое и полное всасывание из желудочно-кишечного тракта (ЖКТ), достижение в течение 30 мин 25–80% максимальной концентрации после приема первой дозы, в это же время в среднем наступает его анальгетический эффект [5]. Нимесулид 100 мг по данным исследований превосходил в выраженности и быстроте анальгетического эффекта целекоксиб 200 мг и рофекоксиб 25 мг у пациентов с остеоартритом [6].
Этот препарат относится к группе противовоспалительных препаратов с умеренной селективностью, за счет чего имеет более редкую частоту неблагоприятных реакций со стороны ЖКТ [7]. В отечественных исследованиях [8] не выявлено изменения течения АГ или гемодинамики на фоне применения этого препарата, как и нет бесспорных доказательств гепатотоксичности нимесулида [9]. Хорошая переносимость препарата подтверждается в анализе спонтанных сообщений о нежелательных реакциях, возникавших при использовании нимесулида (Найза) в клинической практике с января 2009 г. по октябрь 2014 г. Выявленная частота очень низкая: менее 1 случая на 150 тыс. курсов лечения для всех нежелательных реакций и менее 1 случая на 1 млн больных [10]. Таким образом, этот препарат сочетает в себе высокую эффективность с хорошей безопасностью, что является важным для коморбидности пациентов с подагрой.
Хочется обратить внимание на то, что используемые пациентом локальные формы НПВП имеют низкую эффективность при подагре и не рекомендуются в таких случаях.
Следующим моментом обсуждения тактики ведения пациента с подагрой является решение вопроса о назначении гипоурикемической терапии и выборе конкретного препарата. Согласно рекомендациям EULAR 2016 [2], показаниями к началу гипоурикемической терапии являются:
– повторяющиеся приступы (≥2 в год);
– тофусы;
– уратная артропатия и/или наличие камней в почках;
– пациенты молодого возраста (<40 лет) – терапию следует начать с момента установления диагноза;
– пациенты с очень высоким уровнем МК в сыворотке крови (>8,0 мг/дл; 480 мкмоль/л) и/или с сопутствующими заболеваниями (почечная недостаточность, АГ, ишемическая болезнь сердца, сердечная недостаточность).
В описанном клиническом случае имеются следующие показания: около 3 эпизодов острых артритов в год, уровень МК – 0,58 мкмоль/л, тофусы на ушных раковинах.
Согласно рекомендациям [2], препаратом первого выбора является аллопуринол, начинать терапию необходимо с низких доз (100 мг/сут) и увеличивать при необходимости на 100 мг через каждые 2–4 нед. для достижения целевого уровня МК в сыворотке (<6 мг/дл (360 мкмоль/л) на протяжении всей жизни). Если при применении соответствующей дозы аллопуринола не удается достигнуть целевого уровня МК, аллопуринол следует заменить на фебуксостат, который более эффективен при лечении пациентов с хронической болезнью почек, чем аллопуринол.
В представленном клиническом случае у пациента нет противопоказаний к применению аллопуринола, нет анамнеза непереносимости аллопуринола, нет ограничений по дозе препарата (СКФ по CKD-EPI – 104 мл/мин), поэтому не ранее чем через 2 нед. после купирования приступа артрита пациенту рекомендовано начать терапию аллопуринолом 100 мг/сут с контролем уровня МК в крови каждые 2–4 нед.
С целью профилактики обострений артрита на фоне приема уратснижающей терапии рекомендуется использовать либо колхицин в суточной дозе 0,5–1 мг, либо НПВП в низких дозах. Длительность такой терапии составляет 6 мес.
Таким образом, использование алгоритмов диагностики и лечения подагры на основе современных рекомендаций даст возможность врачу более быстро и правильно поставить диагноз подагры, а также выбрать наиболее оптимальную персонифицированную терапию для каждого пациента с подагрой.
Литература
1. Ragaba G., Elshahalyb М., Bardin Т. Gout: An old disease in new perspective – A review // J Adv Res. 2017. Vol. 8(5). P. 495–511.
2. Richette P. et al. EULAR evidence-based recommendations for the management of gout // Ann Rheum Dis. 2016. Vol. 0. P. 1–14.
3. Qaseem А., Harris R.P., Forciea М.А. For the Clinical Guidelines Committee of the American College of Physicians. Management of Acute and Recurrent Gout: A Clinical Practice Guideline From the American College of Physicians // Ann Intern Med. 2017. Vol. 166(1). P. 58–68.
4. Neogi T., Jansen T., Dalbeth N. et al. Gout classification criteria: an American College of Rheumatology. European League Against Rheumatism collaborative initiative // Ann Rheum Dis. 2015. Vol. 74(10). P. 1789–1798.
5. Барскова В.Г. Нимесулид в терапевтической практике // Consilium Medicum. 2011. № 2. С. 49–54 [Barskova V.G. Nimesulid v terapevticheskoj praktike // Consilium Medicum. 2011. № 2. S. 49–54 (in Russian)].
6. Bianchi M., Broggini M. A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee // Drugs. 2003. Vol. 63(1). P. 37–46.
7. Castelsague J., Pisa F., Rosolen V. et al. Risk of upper gastrointestinal complication in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepid and Drug Safety. 2012 (Published online in Willey Online Library, doi: 10.1002/pds.3385).
8. Чичасова Н.В., Имаметдинова Г.Р., Насонов Е.Л. Нимесулид в лечении хронических заболеваний суставов // Лечащий врач. 2008. № 4. С. 75–78 [Chichasova N.V., Imametdinova G.R., Nasonov E.L. Nimesulid v lechenii hronicheskih zabolevanij sustavov // Lechashhij vrach. 2008. № 4. S. 75–78 (in Russian)].
9. Venegoni M., Da Cas R., Menniti-Ippolito F. et al. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy // Ann I-st Super Sanita. 2010. Vol. 46(2). P. 153–157.
10. Каратеев А.Е., Журавлева М.В. Анализ спонтанных сообщений российских врачей о неблагоприятных реакциях, возникших на фоне приема нимесулида: гепатотоксические осложнения очень редки // Эффективная фармакотерапия. 2015. № 21. С. 4–13 [Karateev A.E., Zhuravleva M.V. Analiz spontannyh soobshhenij rossijskih vrachej o neblagoprijatnyh reakcijah, voznikshih na fone priema nimesulida: gepatotoksicheskie oslozhnenija ochen’ redki // Jeffektivnaja farmakoterapija. 2015. № 21. S. 4–13 (in Russian)].
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Источник


