Может быть ожог от химиотерапии
Лучевая терапия широко используется при лечении раковых опухолей. Такая процедура приводит к развитию разных негативных последствий со стороны кожи. И сегодня мы разберемся, почему появляется ожог после лучевой терапии и как его лечить.
Влияние на кожу
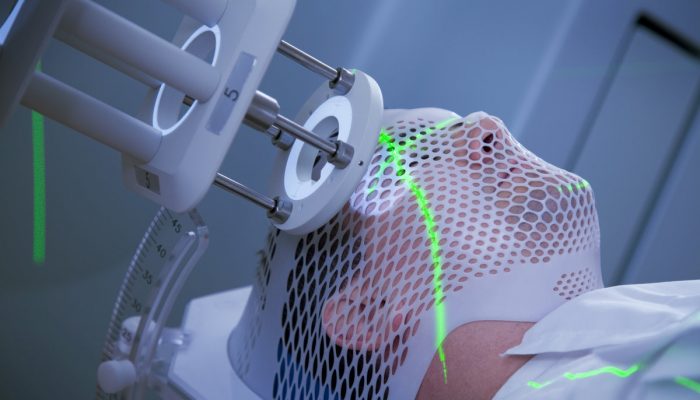
Облучение приводит к нарушению разных функций кожных покровов. После такой процедуры кожа теряет устойчивость к разным механическим воздействиям, становится более чувствительной и нежной, поэтому нуждается в бережном отношении и тщательном уходе. Также лучевая терапия часто оканчивается появлением ожогов. Реакция кожных покровов на облучение может проявиться покраснением и даже более серьезными травмами, и ее выраженность определяется индивидуальной чувствительностью пациента. Симптомы ожогов возникают в среднем на 2—3 неделе терапии. На коже могут образоваться волдыри, которые способны вскрываться и формировать мокрые эрозивные и болезненные участки. При отсутствии адекватной терапии и полноценного ухода такие повреждения эпидермиса с легкостью становятся входными воротами для инфекции.
Степени поражения кожных покровов при лучевой терапии сравнимы со степенью тяжести обычных ожогов:
- 1 степень. В такой ситуации пациент обнаруживает лишь небольшое покраснение эпидермиса. Со временем на коже наблюдается также выраженное шелушение, стянутость или отек.
- 2 степень. В такой ситуации на коже возникают пузыри, которые могут лопаться.
- 3 степень. Это достаточно серьезное состояние, для которого типично возникновение омертвевших участков эпидермиса, а также возникновение язвенных высыпаний.
- 4 степень. Это очень редкое последствие, при котором кожа обугливается и покрывается волдырями.
Чаще всего лучевая терапия приводит к появлению ожогов 1 и 2 степени тяжести, они поддаются лечению в домашних условиях. Возникновение более серьезных повреждений кожи является однозначным показанием для госпитализации.
Как проводится лечение?
Для терапии ожогов после лучевой терапии нужно ориентироваться на степень поражения кожных покровов. Если речь идет об ожоге первой степени тяжести, достаточно лишь придерживаться правильной гигиены и использовать увлажняющий и защитный крем в соответствии с рекомендациями доктора. Если же кожа пострадала сильнее, требуется более серьезное лечение. В частности, пациентам с серьезными ожогами могут прописать
- Гормональные кремы.
- Специальные повязки.
- Лекарства, предупреждающие присоединение инфекции.
- Препараты, стимулирующие восстановление кожи.
При появлении ожогов после лучевой терапии желательно проконсультироваться с врачом. Специалист оценит серьезность ситуации и подберет эффективное лечение.
Общие рекомендации
Стоит учитывать, что лечение ожогов после лучевой терапии — это достаточно длительная и непростая задача. Пациентам с такой проблемой важно не только применять специальные лекарства для нанесения на кожу, но и:
- Придерживаться особенной гигиены. Не стоит принимать ванну, разрешен лишь душ. Для мытья нужно использовать мягкие моющие средства, желательно, гипоаллергенные. При мокнущих ожогах возможность и правила проведения водных процедур нужно обязательно согласовать с лечащим врачом.
- Избегать трения и раздражения кожи. Таких рекомендаций нужно придерживаться сразу после проведения лучевой терапии еще до появления каких-либо видимых изменений на коже.
- Защищать кожу от воздействия ультрафиолета. При выходе из дома нужно надевать одежду, закрывающую как можно больше тела. На открытые участки кожи необходимо наносить солнцезащитный крем.
- Придерживаться диетического питания и пить достаточное количество обычной чистой воды.
Перечисленные рекомендации помогут легче справиться с последствиями лучевой терапии для всего организма и кожи. В каждом конкретном случае особенности ухода за кожей могут меняться в зависимости от советов лечащего врача.
Чем лечить из лекарств?
Существует несколько препаратов, которые могут оказаться очень полезными для пациентов с ожогами после лучевой терапии. Среди них:
- Бепантен и Бепантен Плюс. Такие препараты содержат один основной компонент — декспантенол (производное витамина В5). Они отлично смягчают кожу, питают ее и успокаивают. Также препараты с декспантенолом замечательно стимулируют регенерацию кожных покровов. Их нужно использовать уже в первые дни проведения лучевой терапии (до появления видимых изменений на коже). Применение таких средств поможет избежать более серьезных ожогов. Бепантен Плюс имеет в своем составе также хлоргексидин, который обладает антисептическими качествами.
- Современные сетчатые мягкие повязки, к примеру, ЛикоТюль или СиликоТюль. Это атравматичные, пластичные и комфортные повязки, которые не стесняют движений, создавая эффект «второй кожи». Они не оставляют волокон в ране, легко и безболезненно снимаются, на них сверху можно наносить лекарственные препараты. Такие повязки подойдут при появлении мокнущих ран.
- Повязка ЛикоСорб. Это абсорбирующая адгезивная повязка, которая поможет скорейшему заживлению обильно- и умеренноэкссудирующих ран. Средство имеет неадгезивную атравматичную основу.
- Судокрем. Этот препарат имеет в своем составе цинка оксид. Он обладает антисептическими, вяжущими и противовоспалительными качествами. Препарат неплохо снимает раздражение и способствует заживлению ожогов и ран.
- Эплан. Это современное лекарство с комплексным составом и массой положительных качеств. Он обладает ранозаживляющими и регенерирующими свойствами. Также он характеризуется бактерицидными качествами, обезболивает, защищает кожу и смягчает ее. Его применение позволяет избежать инфицирования раны.
- Солкосерил или Актовегин. В составе таких средств находится депротеинизированный диализат из крови здоровых молочных телят. Это вещество является активным стимулятором регенерации тканей. Его применение помогает справиться с мокнущими ранами и простыми ожогами, предупредить инфицирование и существенно ускорить восстановление.
- Гормональные мази. Такие препараты оказывают быстрое противовоспалительное воздействие, их применяют при ожогах 2 и 3 степени в течение короткого временного промежутка.
Схема лечения ожогов после лучевой терапии подбирается в индивидуальном порядке лечащим врачом. Такие травмы требуют особенного подхода, поэтому для избавления от них могут использоваться далеко не все лекарственные препараты.
Признаки инфицирования раны
Заподозрить присоединение инфекции можно по следующим симптомам:
- Усилению болезненных ощущений.
- Резкой отечности.
- Увеличению красноты.
- Появлению значительного количества жидкости в ране.
- Возникновению неприятного запаха.
Также на присоединение инфекции может указывать и повышение температурных показателей. Однако такой симптом может возникать и как естественное последствие лучевой терапии. В любом случае в такой ситуации требуется дополнительное обращение к врачу.
Профилактика появления
Чтобы снизить риск развития ожогов после лучевой терапии, врачи рекомендуют:
- Тщательно придерживаться правил гигиены, с аккуратностью принимать душ. Такую водную процедуру можно проводить ежедневно. Следует использовать мягкое мыло.
- При облучении подмышечной области следует пользоваться не дезодорантом, а детской присыпкой. Также не стоит применять антиперспиранты и ароматизированное мыло. Брить волосы под мышками нельзя.
- Не стоит прикладывать грелки (теплые либо холодные) к области облучения, а также наносить на кожу спиртосодержащие составы.
- Желательно применять лишь те уходовые средства, которые рекомендует врач.
- При применении каких-то средств по уходу за кожей в дни облучения важно наносить их как минимум за 4 часа до процедуры.
- Чтобы избежать слишком выраженной кожной реакции, стоит применять тот же Бепантен или растительные и животные масла для нанесения на эпидермис после проведения лучевой терапии.
- При появлении выраженной реакции на коже необходимо обсудить с доктором возможность совершения небольшого перерыва в лечении.
- Важно постоянно защищать кожные покровы от ультрафиолета. Эта рекомендация остается актуальной даже после окончания лечения, так как лучевая терапия увеличивает риск развития раковых заболеваний кожи в течение всей жизни. Необходимо исключить посещение солярия.
Легкая болезненность считается абсолютно нормальной реакцией кожи на проведение лучевой терапии. Однако выраженный дискомфорт требует дополнительной консультации с доктором.
Кожа при химиотерапии

Химиотерапия также отрицательно сказывается на состоянии кожных покровов пациента. Такая процедура может приводить к:
- Сухости.
- Зуду.
- Покраснению.
- Болезненным ощущениям.
- Повышенной чувствительности к солнечным лучам.
- Развитию крапивницы и пр.
При появлении вышеперечисленных симптомов стоит проконсультироваться с врачом. Коже нужно обеспечить адекватный и комплексный уход.
Источник
Токсическое действие на кожу и ее придатки
Поражения кожи токсического генеза относительно стандартны по проявлениям и свойственны отдельным цитостатикам и группам препаратов.
Часть кожных реакций носит отчетливо аллергический характер.
Ранние побочные эффекты выражаются появлением эритемы, уртикарной сыпи и могут сопровождаться кожным зудом, повышением температуры тела и снижением чувствительности с последующим развитием гиперестезии и парестезии.
Позднее они способны трансформироваться в довольно стойкие дерматопатии типа гиперкератоза, продуктивной (нередко бляшковидной) сыпи, десквамации с возможным развитием вторичной инфекции, гиперпигментации (кожи, ногтей, слизистых оболочек).
Гиперпигментация кожи в виде четко очерченных пятен или полос характерна для блеомицина, пепломицина, бусульфана. Фотосенсибилизирующий эффект наблюдается при лечении фторурацилом и дакарбазином. Множественные склеротические изменения кожи (нодулярные образования в ее толще), гиперкератоз, иногда некрозы — довольно характерные осложнения химиотерапии (XT) блеомицином.
Кожные лучевые реакции (эритема, десквамация, гиперпигментация) могут отмечаться в процессе лечения дактиномицином или после его окончания. Для прокарбазина (Натулан) характерны клинические изменения в виде эритематозных (кореподобных) экзантем, для метотрексата — макулопапулезных высыпаний. Токсикодермии при лечении противоопухолевыми антибиотиками обычно протекают более тяжело и с выраженным ульцеративно-экссудативным компонентом.
При использовании таксанов отмечаются гиперкератозы, десквамация кожи, сыпь, кожный зуд, изменение ногтей. Кожная токсичность более выражена при лечении доцетакселом. При лечении капецитабином, 5-ФУ в виде длительных инфузии, пегилированным липосомным доксорубицином, со-рафенибом часто отмечается избирательная десквамация, отек, гиперемия кожи стоп и кистей (ладонно-подошвенная эритродизестезия).
Ладонно-подошвенный синдром (ЛПС) I степени не нарушает повседневной активности больного и проявляется онемением, дизестезиями и парестезиями, покалыванием или покраснением ладоней и/или подошв, физическим дискомфортом. ЛПС II степени характеризуется болезненным покраснением кожи и отеками кистей и/или стоп, причем вызываемый этими симптомами дискомфорт нарушает повседневную активность пациента.
При ладонно-подошвенном синдроме III степени наблюдается влажная десквамация, изъязвление, образование пузырей и резкая боль в кистях и/или стопах, а также сильный дискомфорт, делающий невозможными для пациента любые виды повседневной активности. При ЛПС II или III степени применение препарата нужно прервать до исчезновения симптомов или их уменьшения до I степени. IV степень токсичности характеризуется наличием инфицированных осложнений, требующих госпитализации.
В настоящее время рекомендуются следующие мероприятия для уменьшения проявлений ладонно-подошвенного синдрома:
• снижение дозы препарата при возобновлении лечения;
• применение кожных кремов, содержащих вазелин, ланолин или молочную кислоту.
После нанесения крема следует надеть хлопковую перчатку и/или носок (особенно на ночь), чтобы максимальное количество крема могло всосаться и кожа оставалась покрытой им.
Иногда могут рекомендоваться местные или пероральные кортикостероиды, витамин В6 (пиридоксин). Применение пиридоксина в широко варьирующей дозе от 50 до 150 мг 3 раза в сутки в течение 6 нед. может способствовать уменьшению ЛПС при лечении капецитабином (Кселода). Витамин В6 не рекомендуется применять при комбинации капецитабина с цисплатином, т.к. он может снижать эффективность последнего.
Также могут использоваться холодные ванны или прикладывание к наиболее проблемным местам пакетов с замораживающим гелем. Охлаждение ладоней и стоп уменьшает кровоток и может сделать все симптомы ладонно-подошвенного синдрома менее выраженными. Иногда помогает приподнятое (высокое) положение стоп и ладоней. При развитии ЛПС пациентам рекомендуется носить комфортную и свободную одежду и обувь, дома — домашние тапочки.
Длительное использование горячей воды для рук и ног недопустимо. Для мытья рекомендуется холодная или слегка подогретая вода. После мытья кожу следует осторожно промокать досуха, но не растирать. Все открытые участки кожи должны быть защищены от солнечных лучей при нахождении вне дома. Нельзя допускать сухости кожи на руках. Рекомендуется использовать мягкие увлажняющие средства. Должны быть также исключены все виды физической деятельности, которые могут оказывать давление на кожу или трение, включая домашнюю работу, спорт, длительные пешеходные прогулки.
Многие из токсических реакций кожи (гиперпигментация, склеротические изменения, гиперкератоз, язвы) и трофические изменения ногтей проходят самостоятельно и довольно быстро после прекращения XT. Такие изменения кожи, как гиперпигментация, гиперкератоз, как правило, отмены лечения не требуют. Поражение кожи — типичное осложнение при использовании ингибиторов EGFR (гефитиниб, эрлотиниб, цетуксимаб).
Алопеция — проявление токсического повреждения придатков кожи при использовании некоторых противоопухолевых препаратов. Это осложнение возникает в результате подавления пролиферации эпителия волосяных фолликулов. Алопеция обратима, однако является тяжелой психической травмой.
Она закономерно сопровождает химиотерапию доксорубицином, эпирубицином, этопозидом, таксанами, иринотеканом и отмечается у 10-30% больных, получающих лечение циклофосфамидом, дактиномицином, митомицином, винбластином, винкристином, VM-26, гемцитабином, цисплатином. Полное восстановление волосяного покрова головы происходит через 3-6 мес. после окончания медикаментозного лечения.
Поздние осложнения
Поздние осложнения встречаются нечасто, развиваются в течение года или более длительного периода после проведенного лечения. Наиболее опасными считаются тератогенный, канцерогенный и мутагенный эффекты как отдельных препаратов, так и их комбинаций. При длительном лечении кортикостероидами и ингибиторами ароматазы может развиться остеопороз; при лечении циклофосфамидом, ифосфамидом происходит изменение слизистой оболочки мочевого пузыря и возможно развитие опухолей. У детей при лечении циклофосфамидом, метотрексатом, дактиномицином (Актиномицин D), доксорубицином и кортикостероидами возможны нарушения роста и физического развития.
При использовании метилхлорэтиламина (Эмбихин, Мустарген), бусульфана, хлорамбуцина, циклофосфамида, ломустина, кармустина, прокарбазина бывают случаи бесплодия. Инфертильность возможна при лечении цисплатином, цитарабином, доксорубицином, этопозидом, винбластином. При планировании лечения этими препаратами может осуществляться криоконсервация спермы и ооцитов у пациентов детородного возраста при желании иметь детей после излечения.
Больные, длительно получавшие XT и/или лучевую терапию, имеют более высокий риск развития вторичных опухолей.
В поздние сроки могут развиваться стойкая цитопения, минимальная диастолическая скорость (МДС), иммуносупрессия, нарушение гонадотропной функции, кардиомиопатии, пневмопатии, ухудшение памяти, снижение ментальной функции.
Токсическое действие таргетных препаратов
Появление в онкологической практике новых противоопухолевых препаратов молекулярно-нацеленного действия (таргетных) привнесло дополнения в частоту и структуру побочных реакций. Не обладая в большинстве случаев типичной для химиотерапии токсичностью, таргетные агенты характеризуются развитием новых вариантов побочного действия.
Возникновение инфузионных реакций (как правило, при первом введении) в виде повышения температуры тела, озноба, головной боли, крапивницы, артериальной гипотензии отмечается при использовании ритуксимаба, трастузумаба, цетуксимаба, бевацизумаба. Для профилактики гиперчувствительности к чужеродным белкам применяют анти гнетами иную и кортикостероидную премедикацию.
Если инфузионная реакция легкой или умеренной степени выраженности, следует временно приостановить инфузию, использовать дексаметазон (8-12 мг), жаропонижающие и другие симптоматические средства и возобновить инфузионное введение после купирования симптомов, уменьшив скорость введения. Пациент должен быть предупрежден о возможности отсроченных реакций (до 12 ч после инфузий) и проинструктирован о необходимости обращения к врачу при их возникновении.
Дерматологические реакции, нарушения структуры ногтей достаточно часто сопровождают терапию таргетными препаратами; они, в частности, характерны для ингибиторов EGFR. Угреподобная макулопапулезная сыпь, сухость кожи, шелушение развиваются при использовании гефитиниба, эрлотиниба, цетуксимаба; сорафениб может быть причиной ладонно-подошвенного синдрома.
Большинство кожных реакций развивается в первые 3 нед. лечения, несколько раньше (7-10-й день) при использовании эрлотиниба. После стихания воспалительного компонента может развиться гипо- или гиперпигментация кожи на месте бывших высыпаний. Установлено, что дерматологическая токсичность может быть косвенным показателем эффективности при лечении эрлотинибом и, в меньшей степени, цетуксимабом.
Для профилактики и ликвидации дерматологических реакций требуется щадящий для кожного покрова режим, интенсивное увлажнение кожного покрова, местное применение противовоспалительных средств (пимекролимус, такролимус). использование одновременно с местным лечением антигистаминных препаратов, гидрокортизона; при II степени выраженности и выше назначают тетрациклины.
Токсичность со стороны желудочно-кишечного тракта (ЖКТ) (тошнота, рвота, анорексия) в незначительной степени выраженности характерна для многих таргетных препаратов, но не является лимитирующей и требует стандартных лечебных мероприятий. Диарея наблюдается при использовании эрлотиниба, гефитиниба, сунитиниба, лапатиниба; обычно имеет транзиторный характер и в большинстве случаев хорошо поддается терапии лоперамидом.
Кардиотоксичность развивается нечасто при монотерапии трастузумабом и сунитинибом (до 10% случаев). Однако риск кардиотоксичности возрастает при сочетании трастузумаба с антрациклинами и, в меньшей степени, с паклитакселом, циклофосфамидом. Умеренная артериальная гипертензия возникает на фоне лечения бевацизумабом, сорафенибом и сунитинибом.
Тщательный кардиологический мониторинг (динамика фракции выброса левого желудочка), адекватная оценка состояния сердечно-сосудистой системы и стандартная лекарственная терапия клинических проявлений кардиоваскулярной токсичности позволяют эффективно предупреждать и купировать эти токсические проявления.
Миелосупрессия отмечается в основном при сочетании таргетных агентов с цитотоксическими препаратами.
Изменения свертывающей системы в виде гипокоагуляции и развития кратковременных, преимущественно носовых, кровотечений отмечаются на фоне лечения гефитинибом, сорафенибом. Большого внимания заслуживает гиперкоагуляция с формированием тромбоэмболических осложнений при использовании бевацизумаба. Наибольший риск отмечается у больных старше 65 лет и при наличии в анамнезе артериальных тромбоэмболических осложнений.
При развитии тромбоэмболии лечение бевацизумабом прекращают, вопрос о возобновлении терапии решается индивидуально с учетом динамики клинической картины и показателей коагулограммы.
Бевацизумаб характеризуется и другими нестандартными побочными явлениями различной значимости: развитие протеинурии требует исследования функции почек, тщательного наблюдения. При развитии протеинурии IV степени (нефротический синдром) лечение бевацизумабом следует отменить.
Склонность к нарушению процесса заживления ран обусловливает соблюдение временных параметров при сочетании хирургического вмешательства с использованием бевацизумаба: лечение бевацизумабом следует начинать не ранее чем через 28 дней после операции. В случае планирования хирургического воздействия после терапии бевацизумабом необходимо временно отменить препарат; время между последним введением бевацизумаба и операцией должно составлять не менее 6 нед. При выполнении малого оперативного вмешательства лечение бевацизумабом может быть начато не ранее чем через 7 дней.
Редким (
Описаны различные редкие токсические проявления при использовании таргетных препаратов (гипотиреоз, недостаточность функции надпочечников, конъюнктивит, бессимптомное повышение активности аминотрансфераз и др.).
И.В. Поддубная, Н.Ф. Орел
Опубликовал Константин Моканов
Источник


