Ожог химия уксус вещество ассоциации

Последнее обновление: 14.01.2020
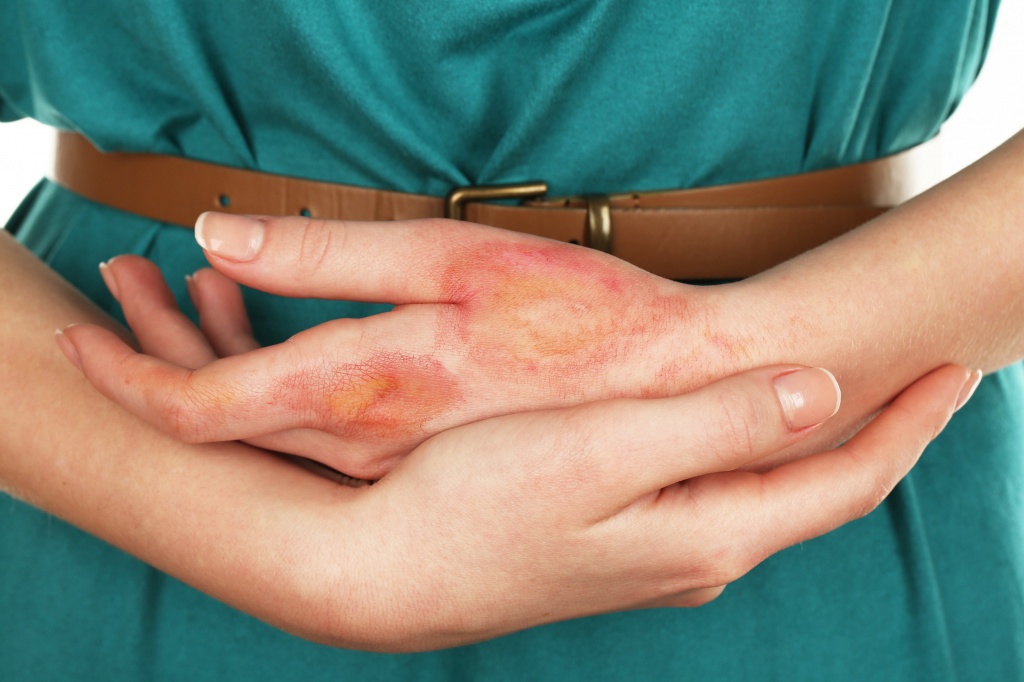
Ожог уксусом легко можно получить в домашних условиях, поскольку столовый, яблочный уксус или эссенция повсеместно используются в быту. Раствор уксусной кислоты обычно имеет небольшую концентрацию – 3%-9%. Но даже в этом случае возможен серьезный химический ожог рук, глаз, слизистых оболочек или пищевода. Поэтому необходимо знать основные методы лечения ожога лица и кожи уксусом, а еще лучше – не забывать о правилах техники безопасности на кухне.
Ожог уксусом относится к разряду химических повреждений. Он происходит после попадания органической уксусной кислоты или столового раствора на тело или внутрь организма человека. В том числе можно получить ожог яблочным уксусом, а также виноградным.
Что делать при ожоге уксусом?
- внешние;
- внутренние.
В первом случае кислота попадает на кожу, лицо, слизистые оболочки, руки – то есть на тело человека. Особенно резкую боль вызывает попадание эссенции в глаза.
Внутреннюю травму можно получить, проглотив уксус. Раствор обжигает гортань, пищевод, желудок. Это повреждение особенно опасно при наличии у потерпевшего болезней ЖКТ.
Чтобы избежать ожога, следует аккуратно обращаться с уксусом и его производными. Однако если несчастный случай уже произошел, необходимо безотлагательно оказать пострадавшему помощь.
Даже если человек, обжегшийся кислотой, находится дома один, но знает принципы оказания первой помощи при ожоге уксусом, он может значительно облегчить боль и снизить глубину поражения. Разумеется, будет еще лучше, если при этом кто-нибудь окажется рядом.
Первая помощь
- Удаление одежды, на которую попал раствор или эссенция (при поражении тела).
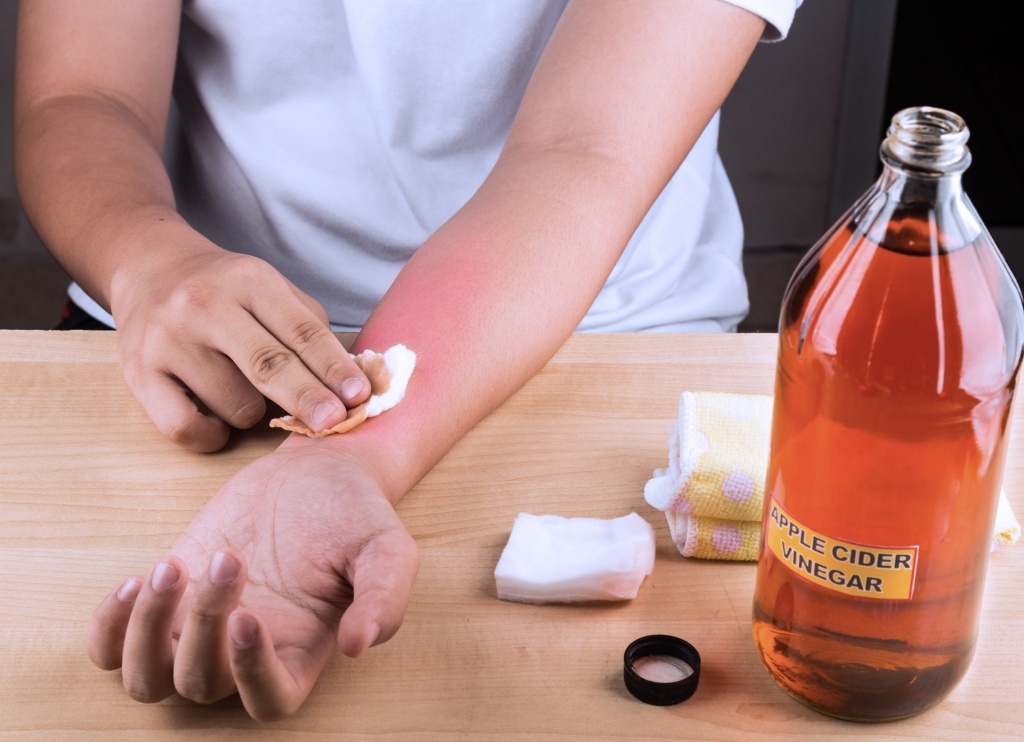
- Промывание пораженного участка проточной водой. Это один из ключевых этапов оказания первой помощи. Вода вымывает вещество с кожи или слизистой оболочки и снижает болевые ощущения. Держать пораженный участок под несильной струей воды нужно не меньше 20 минут.
- Приготовление мыльного или содового раствора. Поскольку уксус – это кислота, нейтрализовать ее воздействие можно щелочью. Хорошо, если кто-то приготовит раствор, пока пострадавший промывает рану водой. Если же рядом никого нет, готовить раствор необходимо после первичного промывания. При попадании уксуса на лицо или глаза, промывание проводят аналогичным образом.
- Наложение влажного компресса и применение антисептических средств с целью снятия воспаления.
- Обращение в больницу или вызов врача на дом. Если травма от уксуса серьезная, необходимо позвать специалистов, которые обработают ожог специальными препаратами, а также назначат дальнейшее лечение.
Внутренний ожог уксусной кислотой классифицируется как более опасная травма, способная привести к тяжелым последствиям, поэтому скорую помощь нужно вызывать безотлагательно.
Сложность ситуации заключается в том, что уксусная кислота усиливает действие соляной кислоты, находящейся в желудке. В результате, ткани пищевода, глотки, ротовой полости и самого желудка могут быть серьезно травмированы.
Известно несколько стадий внутреннего ожога:
- интоксикация, сопровождающаяся шоком;
- токсемия (отравление организма), повышение температуры тела, интоксикационные психозы;
- осложнения в виде гастрита, перитонита, воспаления легких. Ослабленные воздействие уксуса стенки пищевода и желудка легко поддаются инфекции;
- ожоговая астения. Возможно, также, нарушение белкового и электролитного баланса, что приводит к снижению веса пострадавшего человека;
- выздоровление. Своевременно принятые меры и назначенное специалистом лечение являются залогом выздоровления.
Лечением внутреннего ожога от уксуса должен заниматься специалист. Легкий внешний ожог кожи вполне можно обработать самостоятельно.
Лечение

Эффективность лечения напрямую связана с тем, сколько времени прошло после получения ожога, и принимались ли меры первой помощи.
Дальнейшее лечение зависит от степени поражения внутренних органов и может затянуться надолго. В некоторых случаях остаются рубцы, избавиться от которых не удается.
Лечение ожога кожи протекает гораздо быстрее. Основную роль здесь играет своевременное промывание пораженного участка. Далее рану обрабатывают антисептиками, маслами и специальными мазями от ожога уксусом. Подойдут и универсальные средства от ожогов, типа крема «Ла-Кри» восстанавливающего.
После того, как рана зажила, необходимо позаботиться о восстановлении пострадавшего участка кожи. В этих целях отлично подойдет продукция компании «Ла-Кри». Все средства по уходу за руками, лицом и телом изготовлены с учетом высоких стандартов качества: кремы, эмульсия и моющий гель не вызывают аллергической реакции и подходят для обладателей чувствительной кожи, а также для детей.
Крем Ла-Кри для чувствительной кожи предназначен для снятия симптомов повышенной чувствительности и воспалительных проявлений на коже – покраснения, раздражения, зуда, высыпаний и шелушения. Эффективен для снятия зуда после укусов насекомых и ожогов.
В состав крема входят:
- Экстракты череды и солодки обладают противовоспалительными свойствами, оказывают противозудный эффект, снимают покраснение и шелушение кожи.
- Экстракт фиалки и бисаболол (действующее вещество ромашки) обладают противовоспалительным и успокаивающим действием.
- Пантенол и масло авокадо оказывают регенерирующее и смягчающее действие, питают и увлажняют кожу.
- Экстракт грецкого ореха оказывает противомикробное, противовоспалительное и заживляющее действие.
Мнение специалистов
Проведенное клиническое исследование доказывает высокую эффективность, безопасность и переносимость продукции ТМ «Ла-Кри» для ежедневного ухода за кожей ребенка с легкой и средней формой атопического дерматита и в период ремиссии, сопровождающегося снижением качества жизни больных. В результате терапии отмечено снижение активности воспалительного процесса, уменьшение сухости, зуда и шелушения. Средства рекомендованы союзом педиатров России.
Отзывы потребителей
Cherry The Countess (irecommend.ru)
«Всем привет!
Читая мой отзыв о креме от марки Пропеллер, я обещала рассказать еще про одно средство для борьбы с прыщами ,воспалениями и шелушением. Моим любимчиком в этом деле является на данный момент крем Ла-Кри.
Крем Ла-кри для чувствительной кожи фото
Предназначается он для снятия раздражения, зуда и покраснения. Но я нашла в нем толк в лечении моей неидеальной кожи.
Данный крем имеет натуральный состав.
- Масло авокадо — оказывает увлажняющее действие и лечит раны
- Экстракт солодки — оказывает противовоспалительное и противоаллергическое действие
- Экстракт грецкого ореха — антибактериальный,ранозаживляющий эффект
- Бисаболол — успокаивающее действие
- Экстракт фиалки — противоаллергенное,успокаивающее действие
- Экстракт череды — противомикробное,ранозаживляющее,противоаллергическое действие
- Все эти компоненты обеспечивают быстрый и видимый эффект от применения.
Крем очень густой, зелено-коричневого цвета, что подтверждает натуральность состава.
Способ применения: наносить нужно на сухую,чистую кожу лица 1-2 раза в день.Я использую 2 раза,утром после умывания и вечером после снятия макияжа.
Результат: не заставляет себя долго ждать.Уже через 3 дня высыпания стали проходить,а новые даже и не думали появляться.Моя кожа действительно стала увлажненная,без воспалений,заметно чистая.Теперь это моя главная палочка-выручалочка в борьбе с несовершенствами моей кожи и воспалениями на ней.
Я с большим удовольствием рекомендую этот чудо-крем,сделавший мою кожу чистой,без воспалений. Чему я очень рада».
zhahanutik (irecommend.ru)
«Крем «Ла-кри» для чувствительной кожи подходит и для детей, и для взрослых.
Приветствую всех заглянувших! Классический крем «Ла-кри» знаю давно, но только в последнее время стала замечать в аптеках и другие интересные продукты этого производителя. Являюсь обладательницей комбинированного типа кожи со склонностью к раздражению.
«Ла-кри» для чувствительной кожи купила в аптеке, стоимость 230 руб. Брала на случай «чтобы было», тем более область применения у него широкая. Форма выпуска — мягкая непрозрачная пластиковая туба объемом 30 мл.
Крышка откручивается, а выходное отверстие имеет стандартные размеры.
Основное направление действия:
Мне нравится, что крем разрешен к применению даже маленьким детям. Да и входящие компоненты внушают доверие.
Средство густое по консистенции, цвет крема вызывает ассоциации с древесной корой, почему не знаю. Или с землей. Короче с чем-то растительным. Smile Аромат резкий и я не могу назвать его приятным. На любителя. Пахнет входящими в состав экстрактами, возможно, и солодкой.
Несмотря на плотную текстуру, он хорошо распределяется и быстро впитывается. Не оставляет плёнки, лицо с ним не блестит словно «блинчик». Он не скатывается, служит хорошей базой под макияж (в случае необходимости).
Но у него есть одна интересная особенность — при контакте с жидкостью, а также в жару при образовании пота он… мылится или пенится. Предполагаю из-за солодки такой эффект. Поэтому использовать на постоянной основе его не смогла.
Для чего применяю «Ла-кри».
Изначально брала для ухода за чувствительной кожей. Т-зона склонна к жирности, но крем не спровоцировал усиления блеска в течение или забиванию пор, высыпаниям. Познакомилась с ним весной, но по вышеуказанной причине не смогла его долго применять, особенно с наступлением тёплых дней.
Он отлично успокаивает кожу. Бывает, что новая маска вызывает у меня раздражение на щеках. «Ла-кри» быстро приводит лицо в порядок, снимает покраснение, воспаление. Также помогает при шелушении.
Показалось, что он выравнивает тон, благодаря такому специфическому окрашиванию (словно бб крем). Но это вряд ли, скорее дело опять-таки в успокаивающем действии.
Сейчас использую для ребенка (и остальных членов семьи) после укусов насекомых. Пораженные области имеют обширную локализацию (комары реально какие-то злые сейчас), а «Фенистил» что-то особо не справляется. Трудно поверить, но крем работает! Ребенок хоть и на время, но успокаивается и прекращает расчесывать места укусов. Краснота постепенно спадает, а имеющиеся расчесы заживают.
Однозначно рекомендую, исключением лишь является индивидуальная непереносимость определенных веществ в составе».
Источники:
- Молочкова Юлия Владимировна, Дерматология. Краткий справочник, изд-во: ГЭОТАР-Медиа, 2017
- Бауманн Лесли, Косметическая дерматология. Принципы и практика, изд-во: МЕДпресс-информ, 2016
- Ратнер Десири, Аврам М. Р., Аврам М. М., Процедуры в дерматологии. Клиническая косметология, Изд-во: ГЭОТАР-Медиа, 2019
Читайте также
Самые распространенные ожоги — это ожоги бытовые, например, ожоги от электричества, кипятка и конечно же ожоги от химических средств и кислоты.

Химический ожог возникает при соприкосновении кожи с кислотами, щелочами, солями тяжелых металлов и других едких веществ.
При ожогах, независимо от их тяжести, первый удар на себя принимает кожа.
Источник
| Уксусная кислота | |||
|---|---|---|---|
| Систематическое наименование | Этановая кислота | ||
| Традиционные названия | Уксусная кислота | ||
| Хим. формула | C2H4O2 | ||
| Рац. формула | CH3COOH | ||
| Состояние | Жидкость | ||
| Молярная масса | 60,05 г/моль | ||
| Плотность | 1,0492 г/см³ | ||
| Поверхностное натяжение | 27,1 ± 0,01 мН/м[4], 24,61 ± 0,01 мН/м[4] и 22,13 ± 0,01 мН/м[4] | ||
| Динамическая вязкость | 1,056 мПа·с[5], 0,786 мПа·с[5], 0,599 мПа·с[5] и 0,464 мПа·с[5] | ||
| Энергия ионизации | 10,66 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | 16,75 °C | ||
| • кипения | 118,1 °C | ||
| • вспышки | 103 ± 1 °F[1] и 39 ± 6 °C[2] | ||
| • самовоспламенения | 427 ± 1 °C[3] | ||
| Пределы взрываемости | 4 ± 0,1 об.%[1] | ||
| Критическая точка | 321,6 °C, 5,79 МПа | ||
| Мол. теплоёмк. | 123,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −487 кДж/моль | ||
| Давление пара | 11 ± 1 мм рт.ст.[1], 10 ± 1 кПа[6] и 100 ± 1 кПа[6] | ||
| Константа диссоциации кислоты | 4,76 (Ka=1,75*10-5) | ||
| Показатель преломления | 1,372 | ||
| Дипольный момент | 1,74 Д | ||
| Рег. номер CAS | 64-19-7 | ||
| PubChem | 176 | ||
| Рег. номер EINECS | 200-580-7 | ||
| SMILES | CC(=O)O | ||
| InChI | 1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) QTBSBXVTEAMEQO-UHFFFAOYSA-N | ||
| Кодекс Алиментариус | E260 | ||
| RTECS | AF1225000 | ||
| ChEBI | 15366 | ||
| Номер ООН | 2789 | ||
| ChemSpider | 171 | ||
| Пиктограммы ECB | |||
| NFPA 704 | 2 3 1 ACID | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
У́ксусная кислота́ (эта́новая кислота) CH3COOH — органическое соединение, cлабая, предельная одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
История[править | править код]
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей, помимо прочего, ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии[7].
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet)[7].
Завод, производящий уксусную кислоту. 1884 год
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту[8].
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго[7][9].
Физические свойства[править | править код]
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[10].
Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Получение[править | править код]
В промышленности[править | править код]
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[11].
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[11].
Каталитическое карбонилирование метанола[править | править код]
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода[12], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[13] Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США[14].
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году.[15][16] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[11]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[17]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства[править | править код]
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта[18].
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[19]:
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути[править | править код]
— Реакция Кучерова
Химические свойства[править | править код]
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[20].
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями[21].
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Уксусная кислота в биохимии организмов[править | править код]
Уксусная кислота образуется в живых организмах в процессе углеводного обмена, в том числе в организме человека в процессе биохимических реакции, в частности в цикле Кребса, утилизации алкоголя.
Применение[править | править код]
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15%-й — уксусом[22]. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния (что является нежелательным, если только это необходимо для его эвакуации из опасного места его собственными силами).
Токсикология[править | править код]
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³[10][23]. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л.[10] А по данным[24] порог восприятия запаха в группе (среднее значение) может достигать 300—500 мг/м3, что значительно превышает ПДК. Причём у отдельных людей он может быть значительно больше среднего значения.
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %[10]. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[25].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[26]. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту).
Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии, сырого яичного белка, киселя. Нельзя употреблять в этих целях соду, так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды, приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией.
Примечания[править | править код]
- ↑ 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0002.html
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16—19. — ISBN 978-1-4822-0868-9
- ↑ https://www.cdc.gov/niosh/ipcsneng/neng0363.html
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—182. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—95. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31.
- ↑ Goldwhite, Harold. Short summary of the career of the German organic chemist, Hermann Kolbe (англ.) // New Haven Section Bull. Am. Chem. Soc. : journal. — 2003. — September (vol. 20, no. 3).
- ↑ Schweppe, Helmut. Identification of dyes on old textiles (неопр.) // J. Am. Inst. Conservation. — 1979. — Т. 19, № 1/3. — С. 14—23. — doi:10.2307/3179569. Архивировано 29 мая 2009 года.
- ↑ 1 2 3 4 Уксусная кислота
- ↑ 1 2 3 Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- ↑ Advances in Organometallic Chemistry
- ↑ Acetic Acid Production and Manufacturing Process
- ↑ Б. Лич. Катализ в промышленности. Том 1. — Москва: Мир, 1986. — 324 с.
- ↑ U.S. Patent 3 769 329
- ↑ Патент США
- ↑ Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии
- ↑ Кандидат биологических наук Н. Кустова. Уксус. Что это такое и как его делают (недоступная ссылка). Интернет-ресурс «Всякая всячина». Дата обращения 2 сентября 2010. Архивировано 20 октября 2009 года.
- ↑ Биотехнология органических кислот и белковых препаратов: Учебное пособие (недоступная ссылка)
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 15—18. — 2 350 000 экз.
- ↑ Jones, R.E.; Templeton, D.H. The crystal structure of acetic acid (англ.) // Acta Crystallogr. (англ.)русск. : journal. — International Union of Crystallography, 1958. — Vol. 11, no. 7. — P. 484—87. — doi:10.1107/S0365110X58001341.
- ↑ Уксус — статья из Большой советской энциклопедии.
- ↑ (Роспотребнадзор). № 2400. Этановая кислота (уксусная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила).
- ↑ Balavoine P. Observatiojns sur les Qualités Olfactifves et Gustatives des Aliments (англ.) // Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene. — Bern: BAG, 1948. — Vol. 39. — P. 342–350. — ISSN 1424-1307. цитируется по: Odor Threshold Values p. 73.
- ↑ Уксусная кислота : Медицинский портал Eurolab
- ↑ www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка (недоступная ссылка). Дата обращения 16 мая 2011. Архивировано 25 мая 2012 года.
Ссылки[править | править код]
- Уксусная кислота
- Плотность водных растворов уксусной кислоты в зависимости от концентрации
Источник


