Ожог химия уксус вещество одним словом 7 букв игра

| Уксусная кислота | |||
|---|---|---|---|
| Систематическое наименование | Этановая кислота | ||
| Традиционные названия | Уксусная кислота | ||
| Хим. формула | C2H4O2 | ||
| Рац. формула | CH3COOH | ||
| Состояние | Жидкость | ||
| Молярная масса | 60,05 г/моль | ||
| Плотность | 1,0492 г/см³ | ||
| Поверхностное натяжение | 27,1 ± 0,01 мН/м[4], 24,61 ± 0,01 мН/м[4] и 22,13 ± 0,01 мН/м[4] | ||
| Динамическая вязкость | 1,056 мПа·с[5], 0,786 мПа·с[5], 0,599 мПа·с[5] и 0,464 мПа·с[5] | ||
| Энергия ионизации | 10,66 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | 16,75 °C | ||
| • кипения | 118,1 °C | ||
| • вспышки | 103 ± 1 °F[1] и 39 ± 6 °C[2] | ||
| • самовоспламенения | 427 ± 1 °C[3] | ||
| Пределы взрываемости | 4 ± 0,1 об.%[1] | ||
| Критическая точка | 321,6 °C, 5,79 МПа | ||
| Мол. теплоёмк. | 123,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −487 кДж/моль | ||
| Давление пара | 11 ± 1 мм рт.ст.[1], 10 ± 1 кПа[6] и 100 ± 1 кПа[6] | ||
| Константа диссоциации кислоты | 4,76 (Ka=1,75*10-5) | ||
| Показатель преломления | 1,372 | ||
| Дипольный момент | 1,74 Д | ||
| Рег. номер CAS | 64-19-7 | ||
| PubChem | 176 | ||
| Рег. номер EINECS | 200-580-7 | ||
| SMILES | CC(=O)O | ||
| InChI | 1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) QTBSBXVTEAMEQO-UHFFFAOYSA-N | ||
| Кодекс Алиментариус | E260 | ||
| RTECS | AF1225000 | ||
| ChEBI | 15366 | ||
| Номер ООН | 2789 | ||
| ChemSpider | 171 | ||
| Пиктограммы ECB | |||
| NFPA 704 | 2 3 1 ACID | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
У́ксусная кислота́ (эта́новая кислота) CH3COOH — органическое соединение, cлабая, предельная одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
История[править | править код]
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей, помимо прочего, ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии[7].
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet)[7].
Завод, производящий уксусную кислоту. 1884 год
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту[8].
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго[7][9].
Физические свойства[править | править код]
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[10].
Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Получение[править | править код]
В промышленности[править | править код]
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[11].
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[11].
Каталитическое карбонилирование метанола[править | править код]
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода[12], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[13] Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США[14].
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году.[15][16] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[11]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[17]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства[править | править код]
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта[18].
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[19]:
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути[править | править код]
— Реакция Кучерова
Химические свойства[править | править код]
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[20].
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями[21].
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Уксусная кислота в биохимии организмов[править | править код]
Уксусная кислота образуется в живых организмах в процессе углеводного обмена, в том числе в организме человека в процессе биохимических реакции, в частности в цикле Кребса, утилизации алкоголя.
Применение[править | править код]
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15%-й — уксусом[22]. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния (что является нежелательным, если только это необходимо для его эвакуации из опасного места его собственными силами).
Токсикология[править | править код]
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³[10][23]. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л.[10] А по данным[24] порог восприятия запаха в группе (среднее значение) может достигать 300—500 мг/м3, что значительно превышает ПДК. Причём у отдельных людей он может быть значительно больше среднего значения.
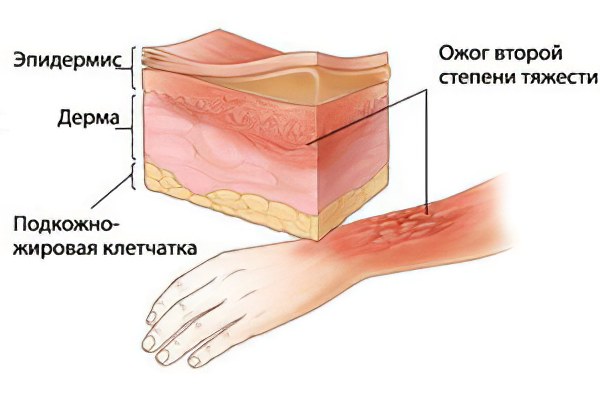
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %[10]. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[25].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[26]. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту).
Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии, сырого яичного белка, киселя. Нельзя употреблять в этих целях соду, так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды, приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией.
Примечания[править | править код]
- ↑ 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0002.html
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16—19. — ISBN 978-1-4822-0868-9
- ↑ https://www.cdc.gov/niosh/ipcsneng/neng0363.html
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—182. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—95. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31.
- ↑ Goldwhite, Harold. Short summary of the career of the German organic chemist, Hermann Kolbe (англ.) // New Haven Section Bull. Am. Chem. Soc. : journal. — 2003. — September (vol. 20, no. 3).
- ↑ Schweppe, Helmut. Identification of dyes on old textiles (неопр.) // J. Am. Inst. Conservation. — 1979. — Т. 19, № 1/3. — С. 14—23. — doi:10.2307/3179569. Архивировано 29 мая 2009 года.
- ↑ 1 2 3 4 Уксусная кислота
- ↑ 1 2 3 Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- ↑ Advances in Organometallic Chemistry
- ↑ Acetic Acid Production and Manufacturing Process
- ↑ Б. Лич. Катализ в промышленности. Том 1. — Москва: Мир, 1986. — 324 с.
- ↑ U.S. Patent 3 769 329
- ↑ Патент США
- ↑ Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии
- ↑ Кандидат биологических наук Н. Кустова. Уксус. Что это такое и как его делают (недоступная ссылка). Интернет-ресурс «Всякая всячина». Дата обращения 2 сентября 2010. Архивировано 20 октября 2009 года.
- ↑ Биотехнология органических кислот и белковых препаратов: Учебное пособие (недоступная ссылка)
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 15—18. — 2 350 000 экз.
- ↑ Jones, R.E.; Templeton, D.H. The crystal structure of acetic acid (англ.) // Acta Crystallogr. (англ.)русск. : journal. — International Union of Crystallography, 1958. — Vol. 11, no. 7. — P. 484—87. — doi:10.1107/S0365110X58001341.
- ↑ Уксус — статья из Большой советской энциклопедии.
- ↑ (Роспотребнадзор). № 2400. Этановая кислота (уксусная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила).
- ↑ Balavoine P. Observatiojns sur les Qualités Olfactifves et Gustatives des Aliments (англ.) // Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene. — Bern: BAG, 1948. — Vol. 39. — P. 342–350. — ISSN 1424-1307. цитируется по: Odor Threshold Values p. 73.
- ↑ Уксусная кислота : Медицинский портал Eurolab
- ↑ www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка (недоступная ссылка). Дата обращения 16 мая 2011. Архивировано 25 мая 2012 года.
Ссылки[править | править код]
- Уксусная кислота
- Плотность водных растворов уксусной кислоты в зависимости от концентрации
Источник
Кислотами называются сложные вещества, молекулы которых состоят из кислотного остатка и связанных с ним атомов водорода, способных замещаться атомами металла с образованием солей, например серная кислота Н2504, азотная — Н1М03, кремниевая — НгЗЮз, соляная — НС1 и т. д. Часть молекулы кислоты без водорода называется кислотным остатком, например ЫОз, $04 — остатки азотной и серной кислот. Кислоты обладают следующими общими свойствами: легко вступают в реакцию со щелочами, образуя при этом воду и новое вещество, называемое солью. Все кислоты окрашивают синюю лакмусовую бумажку в красный цвет, т. е. имеют кислую реакцию.
Кислоты бывают неорганические, или минеральные (соляная, серная, азотная), и органические (щавелевая, уксусная, муравьиная, лимонная, виннокаменная). Органические кислоты значительно слабее минеральных.
Большинство кислот растворяют металл и даже в слабых концентрациях разрушают поверхность его, или, как говорят, вызывают коррозию.
Так как кислоты разъедают металл, то для хранения их применяют тару из стекла или других силикатных материалов.
Кроме того, в некоторых случаях для уменьшения коррозионного действия в кислоту вводят небольшое количество специальных веществ, так называемых ингибиторов, которые устраняют или уменьшают корродирующее действие кислот. Выпускается, например, ингибированная соляная кислота.
Кислоты вызывают раздражение и разрушение тканей кожи. Обжигающее действие кислот зависит от их вида и концентрации раствора. При работе с кислотами должны быть соблюдены меры предосторожности.
Неорганические кислоты
Азотная кислота. Чистая азотная кислота при обычной температуре представляет собой бесцветную жидкость, замерзающую при—41°С с образованием белоснежных кристаллов. Техническая кислота имеет желтоватый оттенок. Азотную кислоту выпускают с различным содержанием основного вещества.
Азотная кислота применяется для чистки изделий. Кроме того, ее используют при никелировании, хромировании металлических деталей, для гравирования.
Серная кислота (купоросное масло). Тяжелая, едкая маслянистая жидкость почти без запаха, бесцветная или с желтоватым оттенком. Крепкая серная кислота поглощает воду, поэтому ее используют для осушения окон, помещая стаканчики с кислотой между рамами.
Разбавленная серная кислота применяется в домашнем хозяйстве для различных целей.
При соприкосновении с органическими веществами (сахар, крахмал, дерево, растительные и животные волокна — хлопок, шерсть и т. д.) крепкая серная кислота отнимает от них воду. Эти вещества разрушаются и обугливаются. Ткани она разрушает, поэтому при попадании на ткань-ее надо быстро нейтрализовать содой.
При ожогах серную кислоту нейтрализуют известью, мелом или содой.
Соляная кислота. Представляет собой раствор хлористого водорода в воде.
Содержание хлористого водорода в соляной кислоте колеблется от 25% до 31%. Очищенная кислота бесцветна, техническая кислота имеет светло-желтый цвет. Кислота легко смешивается с водой. Растворяет металлы (железо, цинк, медь и др.) разрушает ткани, особенно хлопчатобумажные, льняные и искусственный шелк.
Соляная кислота применяется в производстве органических красителей, уксусной кислоты, активированного угля, клея, преципитата, спирта (из древесины), при дублении и крашении кожи, в текстильной промышленности, для пайки, лужения, очистки котлов и аппаратуры, при оцинковке кровельной стали и др.
Для придания кислоте антикоррозийных свойств в нее вводят специальный продукт — ингибитор. Ингибированная кислота для травления цинка непригодна.
Слабую кислоту используют для чистки фаянсовых и эмалированных раковин, ванн, умывальников.
При работе с соляной кислотой необходимо соблюдать осторожность — при попадании на кожу она вызывает ожоги.
Попавшую на руки или одежду кислоту смывают водой и нейтрализуют раствором нашатырного спирта. Разлитую соляную кислоту нейтрализуют известью, мелом, содой, золой. Соляную кислоту хранят в стеклянной посуде.
Фосфорная кислота. Различают термическую фосфорную кислоту (техническую и пищевую) и экстракционную. Техническая кислота прозрачная с желтоватым оттенком, плотность ее не менее 1,53 г/см3. Пищевая кислота бесцветная, плотность ее не менее 1,471 г/см3. Экстракционная кислота (упаренная) — густая жидкость плотностью 1,5—1,6 г/см3.
Пищевую фосфорную кислоту используют при изготовлении газированных вод и для получения солей, необходимых при выпечке печенья и питательных сухарей.
Борная кислота. Представляет собой бесцветные кристаллы или блестящие чешуйки. Содержание основного вещества в продукте не менее 99,5% (I сорт) и 98,5% (И сорт). Получают разложением природных боратов серной кислотой. Применяют в производстве стекла, эмалей, при пайке и сварке металлов, в медицине, а также для подкормки комнатных растений.
Уксусная кислота. Прозрачная, бесцветная жидкость с характерным запахом, бывает разной крепости: 80%-ная, бесцветная называется уксусной эссенцией; 60%ная, техническая (желтоватого цвета), применяется на производстве; 4—7%ная (уксус) используется чаще всего в быту.
Безводная (или ледяная) уксусная кислота представляет собой кристаллы, похожие на лед с температурой плавления 16,6° С.
Уксусная кислота бывает различных видов: биохимическая, лесохимическая и синтетическая. Биохимическая уксусная кислота (винный уксус) получается при брожении спиртовых жидкостей (вино, слабый спирт). Так производят главным образом столовый уксус.
Лесохимическую уксусную кислоту получают из продуктов сухой перегонки дерева экстракцией растворителями.
Синтетическую уксусную кислоту получают путем окисления ацетальдегида, который в свою очередь производится из ацетилена.
Уксусную кислоту применяют в различных отраслях народного хозяйства: в качестве консервирующего средства и вкусового продукта для добавки к пище, в текстильной промышленности при крашении и печатании тканей, для производства солей уксуснокислого натрия, алюминия, свинца (так называемый свинцовый сахар), уксуснокислой меди, в качестве исходного материала для синтеза сложных! уксусных эфиров (этил-ацетат, бутилацетат, амилацетат, бензилацетат и др.), уксусного ангидрида, ацетилцеллюлозы, ацетона, винилацетата, хлоруксусной кислоты, в фармацевтической промышленности и др.
Разбавленная уксусная кислота не действует (даже при нагревании) на волокна растительного и животного происхождения. Она широко применяется для выведения пятен от фруктов, нейтрализации щелочей, умягчения жесткой воды, подкисления воды при окончательной промывке вещей после стирки с целью восстановления и оживления красок, придания шелку блеска. Уксусную кислоту надо хранить в стеклянной посуде.
Лимонная кислота. Представляет собой бесцветные прозрачные кристаллы, без запаха. Хорошо растворяется в воде и спирте. Слабые растворы (1—2%ные) имеют приятный кислый вкус. Применяется в производстве лимонадов, в кондитерском деле, в текстильной промышленности в качестве протравы при ситцепечатании, а также в медицине и в быту (для выведения пятен от ржавчины, красок, чернил, ягод, вина и др.).
Пищевая лимонная кислота должна иметь основного вещества не менее 99% и не должна содержать щавелевой кислоты. В лимонной кислоте, полученной из растительного сырья, допускается примесь яблочной кислоты.
Щавелевая кислота или «сахарная соль». Представляет собой бесцветные кристаллы, хорошо растворимые в воде. При нагревании и в крепких растворах вредно действует на волокна растительного происхождения. 5%ные растворы щавелевой кислоты применяют для удаления пятен от ржавчины, красок, чернил и др. Хранят кислоту в стеклянных банках. Обращаться с ней надо осторожно, так как она ядовита.
Муравьиная кислота. Чистая кислота — бесцветная жидкость, дымящая на воздухе, со своеобразным острым запахом. Продается в виде 80%ного раствора. Получают разложением серной кислотой формиата натрия — продукта взаимодействия окиси углерода с едким натром. Применяют в текстильной промышленности при крашении и печатании тканей, в кожевенной промышленности для отмывания извести с кож после удаления волоса, в консервной промышленности, в винокурении и пивоварении для дезинфекции винных и пивных бочек, а также в химической промышленности для получения сложных эфиров.
Муравьиная кислота становится более доступной и дешевой органической кислотой и в ряде химических производств постепенно вытесняет уксусную, а при крашении и печатании тканей — щавелевую, винную и молочную кислоты. В быту применяется для удаления некоторых видов пятен с тканей и др.
Муравьиная кислота ядовита. Попадая на кожу, она вызывает сильное раздражение и ожоги. Обращаться с ней следует осторожно.
Виннокаменная кислота (винная, диоксиянтарная). Представляет собой бесцветные крупные или мелкие кристаллы и порошок с приятным кислым вкусом, легко растворимые в воде и спирте. Получают ее из отходов виноделия. Содержание виннокаменной кислоты в продукте в пересчете на сухое вещество не менее 99%. Применяют в качестве протравы при крашении и ситцепечатании, при приготовлении фруктовых эссенций. В домашних условиях используют для удаления пятен от чернил, ягод, вина и др.
При растворении кислоты в дистиллированной воде должен получаться прозрачный раствор, не содержащий механических примесей, без запаха.
Источник: djht.ru
Источник